|
Corso di chimica generale ed inorganica
Vai all'INDICE GENERALE
2 - qualche tappa "preistorica"
e "storica" della teoria atomica
Esaminare la storia
della elaborazione di un modello è importante per rendersi conto di come avvenga lo
sviluppo della conoscenza scientifica ed anche per capire che ogni modello
non può essere considerato definitivo e perfetto: lo è solo fino a quando i dati
sperimentali rientrano nel modello disegnato ed accettato; quando essi divergono, occorre
modificarlo o, addirittura, cambiarlo totalmente.
Fig.2.1 Schematizzazione dei processi che portano alla costruzione e al
mantenimento di un modello scientifico.
Lo schema rappresenta
una elaborazione delle teorie di Popper:
la realtà
(cioè uno o più fenomeni reali), mediante processi di analogia, viene
rappresentata in un modello; questo viene implementato (costruito
razionalmente), generalizzato (anche ad altri fenomeni analoghi) e codificato (mediante
strumenti e conoscenze matematiche viene espresso in modo "formale"); questa
sequenza di processi porta ad una teoria.
Ogni teoria deve essere poi
falsificata (messa in crisi con nuove esperienze o utilizzando nuovi dati sperimentali),
particolarizzata (applicata al fenomeno specifico) ed estesa (ad altri fenomeni). Se
questa sequenza regge, il modello viene mantenuto; se non regge il modello deve essere
adeguato (modificandolo) oppure può essere necessario anche cambiarlo totalmente. |
 |
L'esempio della teoria atomica
è esemplare ed emblematico, tanto più che copre un arco temporale enorme, di circa 2500
anni; ma il processo di costruzione di ogni modello ha avuto traversie simili, seppure in
un arco di tempo più ridotto.
Quasi sempre esso è ricostruibile
attraverso il pensiero e le opere di grandi personaggi della storia della scienza.
Verranno ricordate solo alcune delle moltissime tappe significative; dei vari personaggi
inoltre verranno menzionate solo le idee che possono riferirsi agli attuali modelli:
ovviamente essi hanno espresso anche idee contrastanti o devianti rispetto ai modelli, ma
sarebbe troppo dispersivo citarle.
Democrito (460-370 a.C.):
descrive un primo completo e coerente sistema materialistico: esistono "atomi"
(dal greco a-tomos =
indivisibile) immersi in uno spazio vuoto; dal
loro movimento derivano tutte le cose, in modo meccanico e deterministico.
Epicuro (341-270 a.C.):
l'universo è eterno ed immutabile ed è costituito da atomi immutabili; questi sono di
infinite forme, pesi e grandezze; gli atomi, cadendo, possono deviare dalla loro
traiettoria, creando eventi imprevedibili (il determinismo non è più rigido). Nella
cultura latina la filosofia epicurea è stata diffusa da Tito Lucrezio Caro,
noto semplicemente come Lucrezio, nello splendido poema "De rerum
natura".
***Occorre notare che queste "teorie
atomistiche" sono puramente filosofiche, poiché escludono l'esperimento per
confermarle (lo escludono in quanto non lo prendono nemmeno in considerazione: le
attività manuali erano considerate di basso livello, inadatto ai cultori della sapienza,
cioè ai "filosofi").
L'atomismo influenzò sempre gli studiosi,
ma nel Medio evo fu accettata la teoria aristotelica dei "principi" (anche Dante
la seguì), teoria più coerente con le idee della Chiesa e non "atea" e
"materialistica". Questo fatto ha condizionato pesantemente il progresso delle
teorie atomiche e della scienza in generale.
Fig.2.2 Rappresentazione delle categorie del mondo naturale secondo
Aristotele e delle possibili trasformazioni che in esso avvengono.
Sono rappresentati i quattro
elementi di Aristotele: fuoco (IGNIS), aria
(AER), acqua (AQUA), terra (TERRA).
Sono indicati i passaggi da
un elemento all'altro per somma (SUMMA) o perdita (REMISSA) di una delle quattro
qualità: caldo (CALIDITAS), umido (HUMIDITAS),
freddo (FRIGIDITAS), secco (SICCITAS).
Inoltre compaiono le
combinazioni possibili e impossibili (COMBINATIO POSSIBILIS, verticali od
orizzontali, e IMPOSSIBILIS, diagonali) fra diverse qualità.
(G.W.Leibniz in Dissertatio de arte
combinatoria, 1666)
|
|
 |
Pierre Gassendi
(1592-1635) fisico e filosofo francese, diffonde la teoria, cercando di conciliarla con la
religione (gli atomi sono creati da Dio); esistono atomi di varie forme, anche con uncini
(concetto di legame); unendosi formano particelle più grandi, "molecole" (il
termine fu codificato solo molto più tardi, ma per molto tempo, fino agli inizi del 1800,
si continuò a usare indifferentemente i termini atomo, elemento, molecola); queste
molecole possono essere così grandi da essere percettibili dall'uomo, magari migliorando
l'"enghiscopio", antenato del microscopio, che lui stesso usava.
Robert Boyle (1627-1691),
irlandese: in "The Sceptical Chymist" afferma che le reazioni avvengono quando
atomi con minore "affinità" sono sostituiti da atomi con affinità maggiore;
(in quel periodo erano molto diffuse le "Tabulae affinitatum", nelle quali varie
sostanze ed elementi erano tabulate su colonne; per ogni sostanza veniva messa in sequenza
l'affinità, cioè la capacità di reagire, di varie altre sostanze; esempi di tabulae
affinitatum compaiono più avanti, nelle figure 2.7, 2.9, 2.10); spiega le proprietà con le forme e il
movimento dei corpuscoli; deve però "purgare" la teoria
dall'"atomismo" di Epicuro; infatti subì un processo per eresia in cui dovette
abiurare dalla teoria di Epicuro.
Isaac Newton (1642-1727),
fisico inglese: i corpi sono formati da particelle primordiali (che chiama
"minima") "tanto dure che non si logorano mai e mai si rompono in
frammenti"; "i corpi composti possono frammentarsi... solo dove queste
particelle sono a contatto..."; "l'agganciamento delle particelle è dovuto al
fatto che esse si attraggono l'un l'altra con una forza che è molto grande... quando sono
a contatto" (Newton cercò di generalizzare anche al mondo microscopico le sue teorie
sulla gravitazione universale).
Leonhard Euler
(1707-1783), matematico svizzero tedesco (anche un matematico, speculatore astratto, si
pone problemi estremamente concreti; sembra un vero "chimico di laboratorio"):
"per la conoscenza degli elementi è necessario... il maggiore numero di esperienze
nelle quali decomporre i corpi fino a ridurli ai loro principi... che potranno venire
considerati elementi...; esistono tanti elementi quanti tipi di atomi esistono..."
Michail V. Lomonosov
(1711-1765), russo: "il fondamento di ciò che è proprio ai corpi naturali va
ricercato nelle qualità dei corpuscoli che li compongono e nel modo della loro reciproca
disposizione; un "principio" è formato da corpuscoli eguali, un "corpo
misto" è costituito da due o più diversi principi..."
Bryan e Williams Higgins,
fisici inglesi seguaci di Newton dal 1775 al 1995: gli atomi di tutti gli elementi sono
solidi e hanno forma sferica o quasi sferica; gli atomi si attraggono con forze
inversamente proporzionali al quadrato delle distanze (teorie gravitazionali).
*** E' da notare che, finora, nessuno di
questi scienziati è stato definito "chimico", dato che allora la chimica
moderna non si poteva considerare ancora nata; i primi pensatori o scienziati erano di
formazione "fisici" (che si interessavano cioè della Natura e delle sue leggi, in greco "fisis" fusis) o medici o matematici.
| Fig.2.3 Un ritratto di John Dalton John Dalton (1766-1844) scienziato inglese, fondatore
dell'atomistica chimica moderna; usando miscele gassose (inizia con lui quella che viene
chiamata "chimica pneumatica", dal
greco "pneuma" pneuma, aria), studia
e chiarisce le relazioni ponderali fra elementi; nel 1801-2 enuncia la "legge delle pressioni parziali"; afferma,
sbagliando (anche gli errori sono importanti, purché vengano poi riconosciuti!), che il
numero di particelle di vari gas in un dato volume sia diverso; afferma che è necessario
determinare numero e peso di tutti gli elementi, che gli atomi di elementi diversi sono
diversi per qualità e peso specifico, che atomi di una stessa sostanza sono identici, che
atomi diversi hanno la capacità di combinarsi in rapporti diversi (giustificando la legge
delle "proporzioni multiple"), che gli atomi sono inalterabili e indivisibili
(giustificando la "legge della conservazione di massa" di Lavoisier), che atomi
di sostanze diverse hanno pesi atomici diversi. |
 |
Dalton effettua il primo calcolo del
rapporto fra questi pesi e quello dell'atomo di idrogeno, compilando una prima tabella di
pesi atomici, il 6 settembre 1803, tabella affetta da errori concettuali, ma fondamentale
perché la prima che sia stata elaborata (gli errori sono legati alla convinzione che il
numero di particelle di vari gas in un dato volume possa essere diverso; d'altronde non
aveva conoscenza dell'esistenza di molecole biatomiche, perciò interpretò le sue
esperienze sulla base che il gas idrogeno fosse H e non H2)
atomo primario |
peso atomico |
note |
| idrogeno |
1 |
da
acqua, come HO |
| ossigeno |
5,66 |
|
| azoto |
4 |
da
ammoniaca ,come NH |
| carbonio |
4,5 |
da
H2CO3, usando 5,66 per O |
| acqua |
6,66 |
come
HO |
| ammoniaca |
5 |
come
NH |
| ossido
nitrico |
13,66 |
come
N2O |
| zolfo |
17 |
da
acido solforoso come SO |
| acido
solforoso |
22,66 |
come
SO |
| acido
solforico |
28,32 |
come
SO2 |
| acido
carbonico |
15,8 |
come
CO2 |
| ossido
di carbonio |
10,2 |
come
CO |
Fig.2.4 Prima tabella dei pesi atomici
elaborata da Dalton (1803).
Egli usò inoltre simboli nuovi per
identificare gli atomi, ma anche per alcuni composti, poiché non esistevano ancora metodi
per individuarli come tali, per esempio KOH e NaOH; adottò anche un modello simbolico per
mostrare che gli atomi potevano unirsi in rapporti diversi, pur immaginando
"molecole" assolutamente improbabili e, alla luce delle attuali conoscenze,
impossibili.
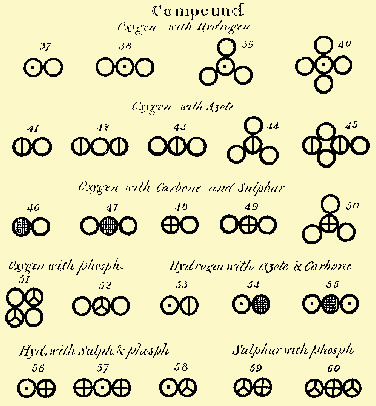
| Fig.2.5 Simboli adottati da Dalton per identificare
elementi o sostanze e molecole ipotetiche tra atomi diversi. La notazione è mista: per ogni elemento la base
è un cerchio, ma prevede anche lettere e simboli grafici aggiuntivi.
Nella prima riga, da sinistra, i primi
simboli sono O, H, N, C, S e P.
Il primo della seconda riga è Hg.
Alcuni simboli corrispondono a composti,
allora ancora non identificabili come tali, per esempio KOH e NaOH, ultimi due della terza
riga; barite, il terzo e MgO, l'ultimo della quarta riga. |
 |
| Fig.2.6 Molecole poliatomiche ipotizzate da Dalton
espresse con i simboli della figura 7a. Nella parte riguardante i composti sono indicati possibili
combinazioni di atomi:
nella prima serie, O con H;
nella seconda O con N;
nella terza O con C ed S;
nella quarta O con P a sinistra e H con N
e C a destra;
nella quinta H con S e P a sinistra, S
con P a destra.
Molte combinazioni sono assolutamente
fantastiche, per esempio OH, O2H, O3H, O4H o ancora HN e
HC, HS e HS2, PS e PS2.
Altre combinazioni rappresentano invece
molecole realmente esistenti, come diversi ossidi di N, di S e di C. |
 |
Per capire l'importanza del contributo di
Dalton allo sviluppo della moderna chimica, con la sua innovativa simbologia, basti
pensare che, prima di lui, vigeva ancora l'abitudine di tentare di "comunicare"
mediante simbologie che si rifacevano all'alchimia ed all'astrologia, con descrizioni di
processi che sembravano più racconti fantastici che esperienze reali e con simboli
fantasiosi e mitologici, più o meno comprensibili anche per gli "addetti ai
lavori".
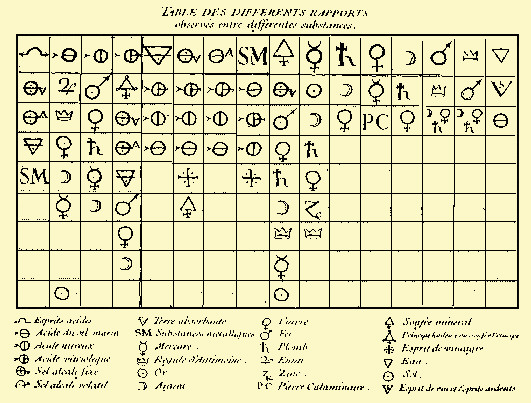
| Fig.2.7 Esempio di "Tabula affinitatum" tra sostanze diverse (E.F.Geoffroy,
1718) di uso comune ancora alla fine del 1700 Nella riga in alto compaiono simboli di sostanze o elementi; nelle
colonne, in corrispondenza ad ogni singolo elemento o sostanza, l'affinità nei suoi
riguardi di altre sostanze o elementi.
Quello che ha la massima affinità si
trova nella seconda riga, poi nella terza e così via, fino alla sostanza o all'elemento
che ha la minima affinità fra quelli considerati.
Il concetto usato nella costruzione della
tabula era che la sostanza che ha maggiore affinità sposta quella che ha minore
affinità.
La simbologia usata è quella
generalmente in uso nell'alchimia (Au = Sole; Ag = Luna; Fe = Marte; Cu = Venere, etc.) |
 |
Per una lettura della tabula, potremmo
nominare le colonne secondo le lettere dell'alfabeto, le righe con i numeri interi
cominciando da uno, secondo lo schema:
|
a |
b |
c |
d |
e |
f |
g |
h |
i |
l |
m |
n |
o |
p |
q |
r |
| 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fig.2.8 Schema per la lettura della Tabula affinitatum.
Così, utilizzando le regole degli
scacchi o della "battaglia navale", e tenendo presente che la riga 1 corrisponde
alla sostanza in oggetto, possiamo individuare un riquadro qualsiasi, per osservare per
esempio che:
- per HCl "acido del sale
marino", colonna b, la massima affinità è presentata da Sn (b2), minore da Cu (b4),
poi Ag (b5), Hg (b6) e, molto lontano, Au (b9).
- per Na carbonato "sale alcalino
fisso", colonna f, la massima affinità è dell'acido solforico (vitriolico) (f2),
poi del nitrico (f3), del cloridrico (f4), dell'acetico (f5, spirito di aceto di vino).
- per Hg, colonna l, teniamo presente che
il mercurio fa amalgama soprattutto con i metalli nobili: primo Au (l2), Ag (l3), Pb (l4),
Cu (l5), Zn (l6), Sb (l7).
- per Ag, colonna o, primo Pb (o2), poi
Cu (o3), con i quali fa leghe; per il resto non ha affinità con altro o quasi: infatti è
un metallo nobile, inattaccabile normalmente anche dagli acidi.
Addirittura non esiste nemmeno una
colonna per Au, essendo praticamente inutile. Si può tentare facilmente di dare una
interpretazione ad altre parti della tabula, alla luce delle conoscenze attuali, per
osservare altre corrispondenze a reazioni note.
E' interessante notare che molti metalli
utilizzano simboli astrologici di pianeti, della luna e del sole: l'oro ha il simbolo del
sole (b9), l'argento quello della luna (b5), il ferro quello di Marte (c2), il rame quello
di Venere (b4), il piombo quello di Saturno (c4), lo stagno quello di Giove (b2), il
mercurio quello di...Mercurio (c5).
| Fig.2.9 Altro esempio di "Tabula affinitatum", detta anche "Table
de rapports", tratta dalla famosa "Encyclopédie ou Dictionnaire raisonné des
sciences des arts et des métiers" di Diderot e D'Alembert, edita a Lucca 1758-1776 Il metodo di lettura è lo stesso e uguale è la
simbologia. |
 |
| Fig.2.10 Un altro esempio, molto raffinato dal punto di vista dell'immagine, è
quello a fianco, " Tabula affinitatum inter differentes substantias", che si
trova presso il Museo delle scienze di Firenze. |
 |
Ma si trattava, comunque di simboli
convenzionali che solo pochi potevano comprendere. L'adozione di simboli per comunicare
con tutta la comunità degli studiosi è equivalente alla costruzione di una lingua in una
società: non esiste progresso se non esiste comunicazione.
| Fig.2.11 Un famoso ritratto di Lavoisier con la moglie, opera di Jacques-Louis
David (ora al Metropolitan Museum of Art di New York) Antoine Laurent Lavoisier (1743-1794): chimico
francese, fu ghigliottinato alla fine della Rivoluzione Francese; studia le reazioni
chimiche e formula il principio della conservazione della massa nelle reazioni chimiche;
genialmente riesce a coordinare in un sistema razionale esperienze e teorie parziali di
molti scienziati europei, creando le basi della "chimica" propriamente detta;
corregge, benché a fatica, data la diffidenza del mondo scientifico verso i cambiamenti,
molti errori concettuali (per esempio la teoria del flogisto, ancora imperante fra esìmi
chimici anche dopo la sua morte, per esempio Stahl). |
 |
Joseph Louis Proust (1754
-1826): formula la legge delle proporzioni definite (per il rapporto in peso degli
elementi costituenti un composto); ciò comporta che esista discontinuità nella materia:
è necessario perciò ipotizzare l'esistenza di "atomi" come costituenti.
Amedeo Avogadro (1776 -
1856) avvocato torinese: deduce, dalle esperienze sui gas di Joseph Louis Gay-Lussac,
chimico francese (combinazioni di sostanze gassose sempre in rapporti definiti e semplici)
e dalle teorie di Dalton che: volumi eguali di gas diversi, nelle stesse condizioni di
pressione e di temperatura, contengono lo stesso numero di particelle, come aveva già
pensato il grande chimico svedese Jacob Berzelius, che però sbagliava in quanto si
riferiva ad atomi e non a molecole; Avogadro infatti ipotizza (1811) che le molecole di
gas usate siano biatomiche (H2, Cl2,
HCl...); in particolare lui parla di "molecole integranti" o
"costituenti" (molecole), composte da "molecole elementari" o
"parziali" o "semplici" (atomi); in questo modo l'ipotesi è
verificabile. Ma la sua idea non viene accettata dal mondo scientifico.
| Fig.2.12 Stanislao Cannizzaro in una sua foto Stanislao Cannizzaro (1826 - 1910) palermitano,
seguì studi di medicina, poiché a Palermo non esisteva altro insegnamento scientifico;
poi ebbe la possibilità di trasferirsi in Piemonte dove ebbe una vera formazione chimica;
stabilisce un metodo di deduzione dei pesi
atomici relativi; riesce a convincere il mondo scientifico della validità dell'ipotesi di
Avogadro e della teoria atomica al primo congresso internazionale di chimica a Karlsruhe,
in Germania, nel 1860.
In tale occasione vengono prese anche altre
importanti decisioni, per esempio sui simboli chimici che saranno convenzionalmente usati
a livello mondiale, sul concetto di "equivalente", sui metodi di determinazione
dei pesi atomici, tanto che a quella data si può far risalire la nascita della chimica
moderna. |
 |
Queste sono solo alcune delle tappe nello
sviluppo iniziale del modello atomistico; moltissimi altri scienziati hanno dato il loro
contributo nello stesso periodo di tempo considerato e ancora più negli anni successivi;
tutti questi contributi hanno permesso l'elaborazione del modello attualmente accettato.
Alcuni testi di riferimento (ma ne
esistono molti altri):
J.I. Solov'ev, L'evoluzione del
pensiero chimico dal '600 ai giorni nostri, EST Mondadori, Milano, 1976.
A. Di Meo (a cura di), Storia
della chimica in Italia, Gruppo Ferruzzi, Edizioni Theoria, Roma Napoli, 1989.
|









