Corso di chimica generale ed inorganica Vai all'INDICE GENERALE
Le radiazioni
luminose (sia visibili che non) sono radiazioni elettromagnetiche; sono
caratterizzate da una frequenza n
4 - radiazioni elettromagnetiche e
atomi
La radiazione si propaga con velocità c che dipende dal mezzo; è massima nel vuoto:
c = 2,997925x10-8 ms-1 (cioè circa 300.000 km/s).
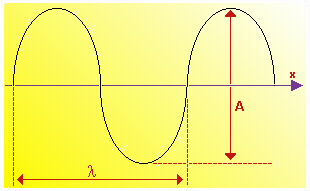
| Fig.4.1 Rappresentazione di un'onda elettromagnetica. La lunghezza d'onda l di una radiazione è lo spazio percorso nella direzione di propagazione x in una oscillazione completa. A è l'ampiezza, che corrisponde all'intensità della radiazione. La lunghezza d'onda è legata alla frequenza n attraverso la relazione l = c/n, in cui c è la velocità della luce. |
 |
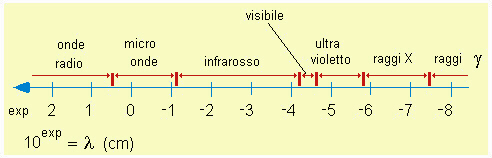
Possiamo rappresentare sinteticamente lo spettro elettromagnetico esprimendo le lunghezze d'onda l su una scala esponenziale.
| Fig.4.2
Scala esponenziale relativa alle lunghezze d'onda e tipi di radiazioni secondo l'abituale
classificazione usata dai chimici. La scala è esponenziale poiché i numeri della scala corrispondono agli esponenti in base dieci che danno l'ordine di grandezza delle lunghezze d'onda. |
 |
I tipi di radiazione che interessano di più al chimico sono:
| radiazione | lunghezza d'onda l |
| infrarosso (IR) | 9 x 10-2 ¸ 8 x 10-5 cm |
| visibile (Vis) | 8 x 10-5 ¸ 4 x 10-5 cm |
| ultravioletto (UV) | 4 x 10-5 ¸ 2 x 10-6 cm |
per il settore della strutturistica chimica (indagini roentegenografiche su cristalli), interessano al chimico anche i raggi X, di energia molto più elevata.
Ogni radiazione è legata ad una energia secondo la relazione E = hn
quantizzata secondo la costante di Planck h (1858-1947; premio Nobel nel 1918) che vale
h = 6,626196 x 10-34 J s
L'interazione luce-materia comporta scambi di E ed avviene per quanti o fotoni, pacchetti di energia hn
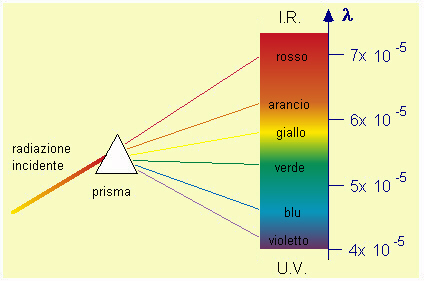
| Fig.4.3
Dispersione di luce visibile nelle sue radiazioni componenti Le radiazioni non monocromatiche (che non sono caratterizzate cioè da una singola l) possono venire disperse (o scomposte) nelle l componenti, mediante prismi o reticoli. Lo schema rappresenta la dispersione della luce visibile, da parte di un prisma, nelle sue radiazioni componenti. Ovviamente lo schema indica soltanto alcune radiazioni; in effetti la dispersione dà luogo ad una successione continua di lunghezze d'onda (come nell'arcobaleno). |
 |
Se eccitiamo degli atomi (sono gli elettroni a subire l'eccitazione, passando a livelli più alti di energia) questi, tornando al loro stato iniziale, emettono radiazioni che possiamo analizzare con un metodo che le disperda: può essere un prisma (per il visibile), come nello schema precedente, oppure un appropriato reticolo (per altre radiazioni).
Analizzando lo spettro emesso dall'idrogeno nella zona del visibile, Johann Jacob Balmer (1825-1898), fisico svizzero, scoprì l'esistenza di una certa regolarità nelle righe dello spettro:
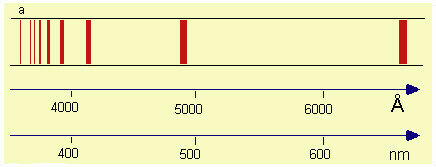
| Fig.4.4
Spettro dell'idrogeno nella zona del visibile. Partendo da destra, la prima riga è molto intensa; la seconda, molto lontana, è più debole; le altre, successivamente, sempre più vicine l'una all'altra e sempre più deboli, fino ad un limite (a), vicino al quale le righe sono così fitte che non si riesce a distinguerle. Oltre il limite non esiste più questa regolarità. |
 |
Balmer, cercando di trovare una relazione matematica che legasse le frequenze delle righe dello spettro, trovò che esse rispettavano rigorosamente la relazione
n' = R(1/4 - 1/n2)
in cui n' rappresenta il "numero d'onda" = 1/l , cioè il numero di oscillazioni complete in un centimetro (è detto anche "Kaiser") ed è espresso in cm-1, R è una costante, molto precisa, detta costante di Rydberg:
R = 109737,31 ± 0,03 cm-1
mentre n può assumere tutti i valori interi a partire da 3: n=3,4,5,6,...
Altri scienziati studiarono altre serie di righe, per l'idrogeno, in altre zone spettrali (cioè ad altri livelli di eccitazione degli atomi di H); in particolare Lyman nella zona dell'ultravioletto e gli altri nella zona dell'infrarosso. (Balmer notò questo fenomeno per primo, per il fatto che lavorava nella zona del visibile, perciò era più facile individuare le radiazioni emesse da H in quella zona dello spettro).
Tutte queste serie di spettri atomici dell'idrogeno si potevano generalizzare nella relazione:
n' = R (1/n22 - 1/n12)
in cui n sono numeri interi e n1 > n2; R è sempre la stessa costante di Rydberg.
Le varie serie di spettri atomici a righe per l'idrogeno si possono ricavare in base ai parametri numerici indicati nella tabella seguente, che riporta anche gli studiosi che le hanno individuate ed elaborate:
n2 |
n1 |
serie di: |
1 |
2,3,4,5,... |
Lyman |
2 |
3,4,5,6,... |
Balmer |
3 |
4,5,6,7,... |
Paschen |
4 |
5,6,7,8,... |
Brackett |
5 |
6,7,8,9,... |
Pfund |
Fig.4.5 Parametri numerici delle serie spettrali e nome dello scienziato che le ha studiate e identificate.
Questi spettri a righe si ottengono solo per emissione cioè restituzione della energia quantizzata assorbita, da parte di atomi isolati (perciò allo stato gassoso).
Quando invece si porta all'incandescenza un solido (anziché atomi isolati, che sono perciò in fase gassosa), si ottiene uno spettro continuo che dipende dalla T a cui si trova il solido.
| Fig.4.6
Spettri di emissione nel visibile di un corpo solido eccitato termicamente. Riportando in diagramma l'E di emissione in funzione della l , si ottengono delle curve a campana asimmetrica, col massimo sempre più alto (maggiore emissione di energia) e a valori di l sempre minori (cioè a frequenza, più alta) mano a mano che aumenta la temperatura di eccitazione. Per contestualizzare il fenomeno, basti pensare alla eccitazione (riscaldamento) di un pezzo di ferro: questo emette dapprima radiazioni invisibili (IR), poi sempre più tendenti verso il rosso, poi al blu, fino ad arrivare al "calor bianco", cioè verso il violetto e l'UV, con emissione di luce sempre più intensa. |
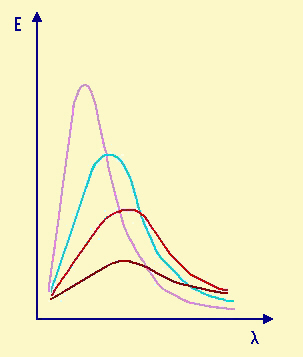 |
Ma come si potrebbe interpretare lo spettro atomico per l'idrogeno? Lo schema può essere quello seguente:
| Fig.4.7
Modello grafico che rappresenta le transizioni spettrali che danno origine alle serie di
righe spettrali per l'atomo di idrogeno. La scala a sinistra è una scala di energia, che viene qui espressa in numero d'onda cm-1, unità di misura spettroscopica. I valori di energia per i vari livelli dell'atomo di idrogeno sono: n=1 (-109678); n=2 (-27420); n=3 (-12126); n=4 (-6855); e così via, con valori sempre più vicini tra loro, fino a n=¥ (0) Il valore 0 di energia è preso arbitrariamente ed è relativo alla situazione in cui protone ed elettrone non interagiscono: si dice che sono "a distanza infinita", con l'elettrone a energia cinetica=0. Tutti gli altri valori sono negativi in quanto corrispondono ad una situazione di stabilizzazione, perciò a energia più bassa. Le freccette rappresentano passaggi da uno stato a maggiore energia ad uno a minore energia: in questi passaggi viene emessa una quantità di energia corrispondente al salto energetico, sotto forma di una radiazione di specifica frequenza (o numero d'onda, che è proporzionale alla frequenza), secondo la relazione DE=hn |
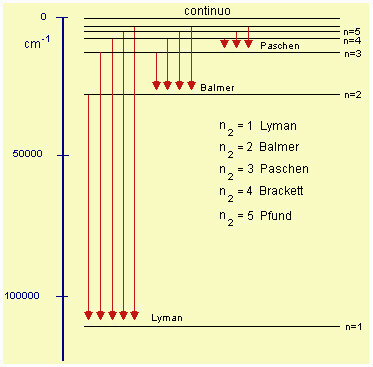 |
Ogni livello energetico, per l'atomo H ha un valore: Ei = -R' x 1/ni2
Un salto energetico tra due livelli diversi sarà perciò:
DE = E2-E1 = -R' (1/n22 - 1/n12)
ma tenendo presente che il numero d'onda è proporzionale a n/c, in cui c è la velocità della luce nel vuoto, si ottiene che il numero d'onda
n' = DE/hc = R (1/n22 - 1/n12)
in cui R è la costante di Rydberg R = 109737,31 ± 0,03 cm-1
Lo stato a minima energia è quello a n=1. Quello a energia zero corrisponde a n=¥, cioè quello in cui l'atomo è ionizzato, ha perso l'elettrone; questo avviene per effetto fotoelettrico: l'atomo assorbe una radiazione di frequenza sufficientemente elevata (detta frequenza di soglia) per permettere l'allontanamento dell'elettrone. Se questa energia è la minima indispensabile, (nel caso di H in situazione n=1, corrisponde al salto energetico da n=1 a n=¥) l'elettrone è "a distanza infinita" dal nucleo, ma "fermo", cioè con energia cinetica nulla; se invece l'energia fosse più alta, l'eccesso sarebbe assorbito dall'elettrone come energia cinetica continua, non più quantizzata.
Anche gli altri atomi danno spettri a righe, ma sono sempre più complessi (e di più difficile interpretazione) di quello dell'idrogeno; cioè ogni atomo ha dei particolari livelli di energia discreti (cioè quantizzati).
I metalli alcalini, avendo un solo elettrone esterno, presentano spettri atomici simili a quello di H (ma con valori energetici diversi); gli alcalino terrosi, con due elettroni esterni, spettri simili a quello di He.
Ci sono perciò analogie in base agli elettroni esterni: gli spettri atomici hanno un carattere periodico e permettono di identificare un atomo qualsiasi, per esempio mediante spettrometria di emissione (analisi delle radiazioni emesse da un corpo eccitato) e spettrofotometria ad assorbimento atomico (analisi delle radiazioni assorbite da un campione).
Atomi con Z abbastanza elevato possono emettere radiazioni ad alta n (cioè alta E), i raggi X; essi furono scoperti nel 1885 da Wilhem Conrad Röntgen (1845-1923, premio Nobel nel 1901).
Nel 1912 Henry Gwyn Moseley (1887-1915) scoprì una relazione fra queste emissioni e il numero atomico degli atomi:
n = a (Z-b)2
in cui
a = 2,564 x 10-15 sec-1 è una costante ed ha le dimensioni di una frequenza, dato che (Z-b) è un numero puro
b = 1,425 è una costante e un numero puro
Z = numero atomico
La legge è empirica (cioè non si conosce un vero modello che giustifichi questo comportamento) ma risulta valida tanto da permettere di correlare con buona precisione Z e n.
|
La radiazione hertziana, meglio nota come "onde radio"
|

|