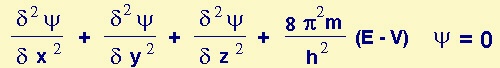Corso di chimica generale ed inorganica
Vai all'INDICE GENERALE
6 - modello per l'atomo di idrogeno
L'atomo di idrogeno,
sulla base dei dati sperimentali, possiede:
- un nucleo con una
carica positiva e quasi tutta la massa dell'atomo
- un elettrone con una
carica negativa e che si muove attorno al nucleo
Nucleo ed elettrone interagiscono
elettrostaticamente; l'energia totale Etot del sistema è costituita da
due componenti, energia potenziale Epot ed energia cinetica Ecin
Etot = Epot
+ Ecin
Epot è l'energia dovuta
alla mutua posizione nucleo-elettrone in ogni istante;
Ecin è l'energia dovuta
al movimento dell'elettrone.
Etot, in assenza di
perturbazioni (dovute ad acquisto o perdita di energia da parte del sistema), è costante
e corrisponde a quella dell'atomo nello stato fondamentale (n=1) a più
bassa E.
| Fig.6.1
Modello dei livelli energetici dell'elettrone di un atomo di idrogeno. Per assorbimento di E quantizzata
l'atomo può passare agli stati eccitati (che hanno cioè n >
1) ; poi in 10-12 s, per emissione di E quantizzata,
può tornare a n = 1.
Stati stazionari sono il
complesso totale di stati, cioè il fondamentale più quelli eccitati (cioè, praticamente
la loro sommatoria Si ni)
Emax = 0 rappresenta
il limite corrispondente alla ionizzazione: in questa situazione infatti Epot
= 0, (l'elettrone è "infinitamente" lontano dal nucleo, perciò non
esiste alcuna interazione tra loro)
Ecin = 0 (l'elettrone
è "fermo", gli viene cioè data l'energia per allontanarlo dal nucleo fino a
distanza "infinita", ma nulla di più che gli permetta di muoversi; questo
"di più" sarebbe energia continua e non più quantizzata). |
 |
Nel modello energetico l'energia E viene
intesa come negativa, poiché la consideriamo come una E di stabilizzazione.
Per descrivere il comportamento
dell'elettrone attorno all'atomo possono essere utili delle funzioni matematiche che
tengano conto del campo di potenziale in cui si trova l'elettrone; ma il campo è
condizionato dalla posizione istantanea dell'elettrone rispetto al nucleo e questa è
rappresentabile con un sistema di coordinate cartesiane in cui l'origine degli assi
coincide con il centro del nucleo M.
| Fig.6.2
Posizione dell'elettrone e rispetto alle tre coordinate cartesiane la cui origine
è costituita dal nucleo dell'atomo M.
La posizione dell'elettrone, rispetto a
questo sistema di riferimento, è definita, in ogni istante, da una terna di valori (xi,
yi, zi).
Una rappresentazione perfettamente
equivalente dal punto di vista operativo può essere ottenuta anche mediante coordinate
polari. |
 |
| Fig.6.3
Erwin Schrödinger
Nel 1926 Erwin Schrödinger
(1887-1961; premio Nobel nel 1933) sviluppò una equazione differenziale la cui soluzione
è la funzione desiderata, cioè quella che rappresenta la posizione dell'elettrone
rispetto alla sua energia; questa funzione y è
chiamata funzione d'onda.
L'equazione differenziale é:
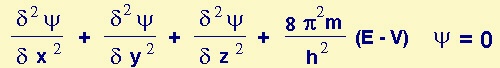
in cui: |
 |
(d2y / dx2), (d2y / dy2), (d2y / dz2) sono le derivate seconde parziali della funzione y rispetto alle direzioni x, y e
z;
m è la massa
dell'elettrone;
E è l'energia totale
dell'elettrone (Etot);
V è l'energia potenziale
dell'elettrone (Epot);
y è la funzione d'onda
E' evidente che il termine (E-V)
rappresenta l'energia cinetica (Ecin)
Sia E sia y sono incognite; trattandosi perciò di una
equazione a due incognite, esisteranno infinite soluzioni dell'equazione: ad un certo
valore per l'energia (detto autovalore) Ei,
corrisponderà una certa funzione yi (detta autofunzione).
Potremo perciò conoscere l'energia
dell'elettrone in funzione dei suoi spostamenti (in effetti la cosa è più complessa, ma
in prima approssimazione questo può essere sufficiente).
Queste y, per gli atomi, possiamo chiamarle orbitali. Ad ogni
stato stazionario corrisponde una yi e perciò una ben determinata Ei.
Le varie y possono avere, tra l'altro, anche "forme" speciali diverse.
Ciò dipende da parametri che sono chiamati numeri quantici.