Corso di chimica generale ed inorganica 9 - aufbau e periodicità Il termine aufbau
significa, in tedesco, "costruzione" e rappresenta, per noi, la costruzione
della configurazione elettronica degli atomi. Per atomi polielettronici è estremamente
difficile risolvere con esattezza l'equazione d'onda; una soluzione approssimata indica
che gli orbitali sono "simili" a quelli monoelettronici di H. Perciò
continueremo a chiamarli 1s, 2s, 2p, 3d, etc.., benché questi siano stati calcolati in
particolare per H. L'energia dipende dal numero quantico n,
ma anche da l, poiché in funzione di l aumenta la repulsione elettronica.
La disposizione degli elettroni negli orbitali di un atomo neutro, al livello minimo di E
è la configurazione elettronica dello stato fondamentale. Per ottenere
questa configurazione si seguono tre criteri operativi o principi: il Principio di minima energia:
ogni elettrone occupa l'orbitale disponibile a energia più bassa. il Principio
di Pauli (Wolfang Pauli, 1900-1958; premio Nobel nel 1945): in un
atomo non possono esistere 2 elettroni con i 4 numeri quantici eguali; perciò, nello
stesso orbitale, possono esserci 2 soli elettroni purché con ms,
momento di spin, diverso; gli spin dei due elettroni devono essere perciò antiparalleli, ¯ dato che, essendo nello stesso orbitale, gli
elettroni hanno gli altri 3 numeri quantici n, l, m,
eguali. la Regola di Hund o della
massima molteplicità: se due o più elettroni occupano orbitali degeneri (cioè
a eguale energia), gli elettroni occupano il maggior numero possibile di questi orbitali,
e a spin paralleli . Seguendo le regole su indicate, e conoscendo la sequenza di
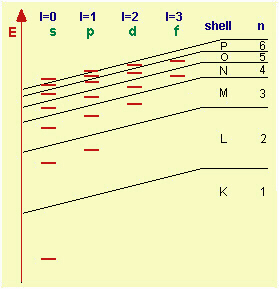
energia per gli orbitali, indicata in figura, si può sapere, per ogni atomo, quali sono
quelli occupati e si può procedere all'aufbau, cioè al riempimento
progressivo degli orbitali con gli elettroni. n definisce il cosiddetto "guscio",
o "shell"; così, per esempio, per n=1 avremo il guscio K,
per n=2 L, per n=3 M, etc. Entro un guscio, orbitali con l
più alta sono a E più alta, sempre a causa delle interazioni elettroniche. m (momento
angolare) e ms (momento di spin), nella Aufbau, non hanno influenza
sull'energia degli orbitali, poichè indicano solo l'orientazione della corrente
elettronica sotto l'effetto di un campo, che quando si parla di atomi isolati, non c'è. Per H (che ha Z=1), n=1,
l=0: la configurazione elettronica potrà venire indicata con 1s
Fig.9.1
Schema energetico per i vari tipi di orbitali, distinti in s, p, d, f, al variare del
numero quantico n; ad ogni n corrisponde un guscio o shell.
Per He (Z=2), n=1, l=0, occorre applicare il principio di Pauli: poiché due numeri quantici sono eguali, occorre che almeno uno degli altri due sia diverso perché il secondo elettrone possa stare col primo; poiché è l=0, è anche m=0; resta solo ms: è necessario che se un elettrone ha ms = +1/2, l'altro abbia ms = -1/2. Devono perciò essere antiparalleli: la configurazione verrà indicata con 1s¯, o, sinteticamente, con 1s2.
N.B. E' chiaro, quando scrivo 1s2, che i due elettroni che si trovano nell'orbitale 1s devono essere obbligatoriamente a spin antiparalleli per il principio di Pauli; perciò scrivo semplicemente il loro numero; analogamente, quando scriverò 2p3 è implicito che i tre elettroni occupino ognuno un orbitale p e che siano tutti e tre a spin parallelo, per il principio di Hund. Questo è un esempio della complessa significatività delle simbologie che usa il chimico e della necessità di possedere profondi requisiti di conoscenza per poter comprendere il significato profondo dei simboli usati.
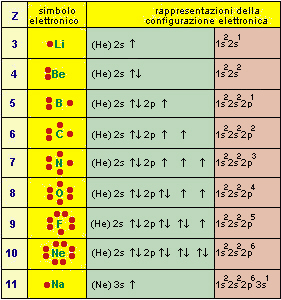
Nella figura successiva sono indicate alcune rappresentazioni equivalenti della configurazione elettronica di alcuni atomi (da Z=3, Li, a Z=13, Al)
| Fig.9.2
Configurazione elettronica del guscio esterno degli atomi con numero atomico da 3 a 13 e
vari tipi di notazione usati per rappresentarla. Nella prima colonna sono indicati i numeri atomici Z. Nella seconda, la configurazione elettronica secondo Lewis: sui quattro lati del simbolo sono evidenziati i doppietti e gli elettroni spaiati (del guscio esterno). Nella terza, una rappresentazione che dà il guscio (shell) già completato, come (He) o (Ne), seguito dal nome degli orbitali disponibili ed occupati; quando il guscio è completato (solo per s e p), cambia il simbolo del gas nobile corrispondente; sono evidenziati anche gli spin accoppiati nel caso di doppietti o, nel caso di elettroni spaiati, gli spin paralleli degli elettroni che occupano orbitali degeneri diversi, secondo la regola di Hund. In una analoga rappresentazione (He) è sostituito dal nome del guscio, K; (Ne) da KL (sono completi ambedue i gusci) etc. Nella quarta una rappresentazione completa della configurazione, che non evidenzia però se gli elettroni si trovano nello stesso orbitale o in orbitali degeneri diversi; ricordando però la regola di Hund, è ovvio, per esempio, che N ha tre elettroni 2p a spin paralleli e in tre orbitali degeneri diversi; l'esponente dei vari tipi di orbitali degeneri indica il numero di elettroni che li occupa. |
 |
La situazione del Li (come poi quella del Na), è simile a quella di H, come già avevamo visto nell'esperienza di Stern e di Gerlach; l'effetto del magnete avviene solo sull'elettrone spaiato ns1 (infatti He, con 2 elettroni antiparalleli, è magneticamente inerte).
Anche gli spettri per altri atomi hanno analogie, ma, al crescere di Z, diventano sempre più complessi.
Finora, nell'aufbau, abbiamo esaminato solo gli orbitali fino al 3p. Infatti, nella tabella dell'E degli orbitali, la sequenza è: 1s, 2s, 3p, 3s, 3p.
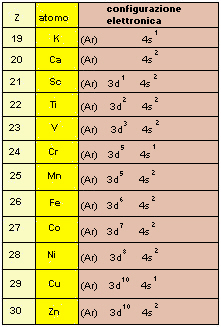
A questo punto, proseguendo il riempimento, poiché i 3d sono a energia leggermente superiore ai 4s, riempiremo prima i 4s e poi i 3d, anche se fanno parte del "guscio" inferiore.
| Fig.9.3 Configurazione
elettronica degli atomi con numero atomico da 19 a 30. K e Ca hanno rispettivamente 1 e 2 elettroni nel 4s. Poi, con lo scandio Sc, iniziano a riempirsi i 3d (3d1 4s2). Seguono titanio Ti e vanadio V (3d2 4s2; 3d3 4s2). Ma quando si arriva a Cr, che dovrebbe avere la configurazione 3d4 4s2, si nota un'anomalia: la configurazione è 3d5 4s1. Questo avviene perché la configurazione elettronica che comporta una serie completa di orbitali degeneri completamente piena o piena a metà (cioè con un elettrone in ogni orbitale) è energeticamente favorita, tanto da utilizzare uno degli elettroni 4s per completare il quintetto. La stessa cosa avviene con Cu, che si trova con tutti i 3d completi, utilizzando 1 elettrone 4s (configurazione 3d10 4s1). Avremo perciò due atomi con 5 elettroni 3d, Cr e Mn, e due atomi con 10 elettroni 3d, Cu e Zn. Cr e Cu, avendo un solo elettrone s, avranno perciò comportamento chimico diverso (diverse valenze) rispetto ad altri atomi con Z vicino al loro. |
 |
L'aufbau è sempre condizionata dalla sequenza energetica degli orbitali disponibili.
Solo dopo aver completato i 3d e i 4s si inizieranno a riempire i 4p, ad energia maggiore (Ga, Ge, As). Analogamente succede quando c'è da riempire, per esempio, i 4d e i 5s, o i 4f e, addirittura, i 6s, etc.
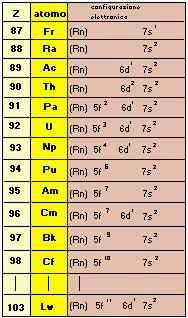
Quando Z è molto alto, la differenza di energia fra i vari tipi di orbitali diventa ancora minore, e potremo avere delle sequenze di configurazione piuttosto strane.
| Fig.9.4
Configurazione elettronica degli atomi transuranici. Gli orbitali 6d vengono utilizzati infatti saltuariamente; dopo l'inserimento dei 2 elettroni 7s, (che avviene col radio Ra) gli elettroni successivi vanno nei 5f o nei 6d a seconda della stabilizzazione che è possibile ottenere. Così potremo avere in sequenza 6d2 7s2 (per il torio Th) e 5f2 6d1 7s2 (per il protoattinio Pa). E ancora 5f4 6d1 7s2 (per il neptunio Np), 5f6 7s2 (per il plutonio Pu), 5f7 7s2 (per l'americio Am) e 5f7 6d1 7s2 (per il curio Cm). Anche qui due configurazioni successive hanno tutti gli orbitali degeneri con un solo elettrone, cioè pieni a metà: Am e Cm. (Ricordare che gli orbitali f sono 7!). (Rn) sta per la configurazione elettronica del radon Rn, ultimo dei gas nobili, con Z=86; la configurazione elettronica completa del Rn è la seguente: 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6 è chiara l'utilità di usare il simbolo anziché la notazione completa. |
 |
Eseguendo queste operazioni di aufbau si possono notare alcune caratteristiche comuni ad alcuni atomi ed evidenziare una periodicità nelle configurazioni elettroniche degli atomi.
Per esempio, alcuni atomi hanno il guscio corrispondente completo e, dal punto di vista chimico-fisico, sono tutti gas monoatomici a temperatura e pressione ambiente, sono molto stabili chimicamente (questa mancanza di reattività ha reso molto difficile la loro scoperta), hanno energia di ionizzazione alta e affinità elettronica quasi nulla. (Il termine "chimicamente", per la stabilità, è stato usato poiché, in effetti, Rn lo è dal punto di vista della reattività chimica, ma non lo è dal punto di vista nucleare: infatti è radioattivo).
Sono stati perciò chiamati "gas nobili".
l'elio He (Z=2) ha guscio K completo
il neon Ne (Z=10) ha anche il guscio L completo
l'argon Ar (Z=18) ha anche il guscio M completo
il kripton Kr (Z=36) ha anche il guscio N completo
lo xenon Xe (Z=54) ha anche il guscio O completo
il radon Rn (Z=86) ha anche il guscio P completo
Gli atomi che li seguono (litio Li con 2s1, sodio Na con 3s1, potassio K con 4s1, rubidio Rb con 5s1, cesio Cs con 6s1, francio Fr con 7s1) hanno ognuno 1 elettrone nell'orbitale s del guscio superiore, ed hanno anch'essi caratteristiche molto simili tra loro: analogo comportamento chimico, analogo comportamento nell'esperienza di Stern e Gerlach, hanno energia di ionizzazione molto bassa e affinità elettroniche paragonabili tra loro... Sono stati chiamati "metalli alcalini".
Analogamente a questi, si possono riconoscere altre "classi" o famiglie di atomi, che sono dette "gruppi", come:
i "metalli alcalino-terrosi" (berillio Be, magnesio Mg, calcio Ca, bario Ba, stronzio Sr, radio Ra) con configurazione degli elettroni esterni ns2
o gli "alogeni" (fluoro F, cloro Cl, bromo Br, iodio I, astato At), con configurazione degli elettroni esterni ns2 np5
Le caratteristiche chimiche indicano che gli atomi tendono, formando legami con altri, ad assumere la configurazione elettronica del gas nobile che li precede o che li segue (poiché, come sappiamo, è una configurazione molto stabile): il comportamento chimico dipende perciò dal numero di elettroni esterni.
Così ogni atomo avrà la tendenza a legarsi con altri atomi secondo rapporti precisi (stechiometrici), che sono definiti come valenza dell'atomo.
Per esempio, con H: LiH (litio idruro), BeH2 (berillio idruro), BH3 (boro idruro), CH4 (metano), NH3 (ammoniaca), H2O (acqua), HF (acido fluoridrico).
Analoghe sequenze si possono riscontrare al crescere di Z e in composti con altri atomi oltre che con H.
Poiché H può perdere o acquistare un solo elettrone il numero di H legati ad ogni atomo è una "valenza" di quell'atomo. Notare che in ogni composto i due atomi componenti assumono formalmente la configurazione di un gas nobile (regola dell'ottetto): He oppure protone "nudo" per H, He o Ne per gli altri.
In base a queste osservazioni sulla periodicità delle caratteristiche elettroniche, chimiche (reattività), fisiche (per esempio stato di aggregazione), chimico-fisiche, si è cercato di organizzare gli elementi in un "sistema periodico", in cui gli elementi a configurazione elettronica simile siano allineati su colonne dette "gruppi", mentre le sequenze legate all'aufbau, cioè al riempimento dei vari gusci, sono detti "periodi".
Molti studiosi hanno cercato di farlo, per esempio: A.E.B. de Chancourtois (elica telluriana), J. W. Döbereiner (sistema delle triadi), J.A.R. Newlands (legge delle ottave).
Julius Lothar Meyer (1830-1895) ne evidenziò la periodicità in base al volume atomico, ma il merito di aver strutturato uno schema razionale, portando l'elaborazione alle estreme conseguenze (per esempio la previsione di elementi ancora sconosciuti), spetta a Dmitrij Ivanoviç Mendeleev (1834-1907)
| Fig.9.5
Dmitrij Ivanovich Mendeleev in una sua foto Egli presentò un lavoro come Faraday Lecture: "The periodical law of the chemical elements" nel 1889. La sua tesi fu completamente accettata quando, nel giro di pochi anni, furono scoperti e identificati alcuni elementi, di cui egli aveva ipotizzato non solo l'esistenza ma anche le proprietà in base alla periodicità, e che corrispondevano perfettamente alle sue previsioni, cioè: il gallio Ga scoperto da P.E.Lecoq de Boisbaudran 1875 lo scandio Sc scoperto da L.F.Nilson 1879 il germanio Ge scoperto da C.Winkler 1885 |
 |
Mendeleev aveva infatti previsto l'esistenza del Ga (da lui chiamato ekaalluminio), dello Sc (ekaboro), del Ge (ekasilicio), in cui aveva utilizzato la radice sanscrita "eka" (che significa "uno"), dato che questi elementi venivano subito sotto, nella sua tavola periodica, di Al, B, Si.
I nomi attuali sono stati dati in onore degli stati da cui provenivano gli scopritori, Francia (Gallio), Svezia (Scandio), Germania (Germanio).
Nella sua ipotesi mancava il gruppo dei gas nobili (o gruppo zero), che, date le difficoltà di individuazione legate alla loro mancanza di reattività chimica, furono scoperti solo molto più tardi, ad opera di altri scienziati (H.P.J.Thomsen, W.Ramsay, A.Errera); questa scoperta risolse un grosso problema di collocazione degli atomi nella tabella.
La tavola originale è riportata in fig.9.6 e risale al 1871, ma la prima stesura autografa, anche se meno completa, è del 17 febbraio 1869.
L'organizzazione della tavola è basata su una sequenza di pesi atomici, non di numeri atomici (le conoscenze del tempo non permettevano di ipotizzarli), come quella che usiamo attualmente.
Quello riportato è uno schema ridotto; ma si possono notare gli atomi di cui egli aveva previsto non solo l'esistenza (indicata con il segno -) ma anche proprietà e peso atomico; le proprietà sono individuate dai gruppi (GRUPPA); inoltre aveva suddiviso, anche se non in modo corretto, gli atomi in periodi (PERHOD).
| Fig.9.6
Prima stesura organizzata della Tavola di Mendeleev (1869-71) Nei riquadri rossi le posizioni dei previsti ekaboro (peso atomico 44), ekaalluminio (68) ed ekasilicio (72). Gli atomi corrispondenti, scoperti successivamente, sono: scandio Sc (massa atomica corretta 44,96), gallio Ga (69,72), germanio Ge (72,61). Nel riquadro verde l'atomo previsto con peso 100, corrispondente al tecnezio Tc (98), artificiale e radioattivo, individuato solo molto dopo. |
 |
Ci sono alcune incongruenze, per esempio per quanto riguarda la composizione dei periodi, la mancanza delle serie di transizione, del gruppo dei gas nobili etc. Ma sostanzialmente questo documento costituisce la base di costruzione delle attuali tabelle periodiche degli elementi, che superano ormai Z=106.
Potremmo ragionevolmente dire che l'intuizione di Mendeleev rappresenti, nella sua complessità di significati e nella sua razionalità, l'essenza stessa della chimica moderna.