Corso di chimica generale ed inorganica 16 - sui legami Dopo avere accennato alla natura dei
legami ionico e covalente, è necessario parlare anche di altri aspetti dei legami. Per esempio, quale è l'energia
di un legame generico? In prima approssimazione l'energia di
legame viene valutata misurando l'energia di dissociazione, cioè
l'energia che occorre fornire per rompere la molecola all'altezza del legame considerato. Supponiamo di avere due atomi A e B e che
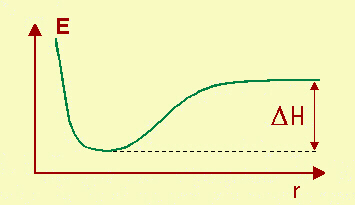
questi formino un legame dando luogo alla molecola AB. Possiamo portare in diagramma l'energia
del sistema AB in funzione della distanza r tra i due atomi: In ascissa r,
distanza tra i due atomi A e B che formano il legame. E', evidentemente, la stessa energia (ma
con segno opposto) che si libera nel processo di formazione della molecola AB. Viene definita, in particolare, come il DH di formazione per una mole di AB. H, entalpia, è una
forma di energia rappresentabile come una funzione di stato, che dipende, cioè, solo
dagli stati iniziale e finale. Per molecole poliatomiche
ABn è definita come il DH di dissociazione totale
negli atomi costituenti, diviso per n:
Fig.16.1
Schema energetico di formazione di un legame interpretata come corrispondente all'energia
della dissociazione.
Per esempio per CH4: DH = 1.66 x 106 J mol-1; perciò l'energia di un singolo legame C-H è 4.45 x 105 J mol-1.
Una tabella delle caratteristiche di legame tra diversi atomi è molto utile per approfondire il concetto di legame.
| tipo di legame | distanza (pm) | energia (kJ mol-1) |
| H-H | 74 |
435 |
| C-C singolo | 154 |
347 |
| C-C doppio | 135 |
522 |
| C-C triplo | 121 |
961 |
| N-N singolo | 147 |
159 |
| N-N doppio | 124 |
350 |
| N-N triplo | 110 |
940 |
| F-F | 144 |
155 |
| Cl-Cl | 199 |
242 |
| Br-Br | 228 |
192 |
| I-I | 267 |
150 |
| H-F | 92 |
564 |
| H-I | 161 |
297 |
| O-H (in H2O) | 96 |
469 |
| N-H (in NH3) | 101 |
389 |
| C-H (in CH4) | 109 |
414 |
Fig.16.2 Caratteristiche energetiche e di distanza di vari tipi di legame. Legami come C-C o N-N risultano più o meno eguali come distanza e come energia, anche se inseriti in una molecola complessa. Aumentando l'ordine di legame aumenta l'energia totale di legame e diminuisce la distanza. Tra le molecole degli alogeni la distanza aumenta e l'energia, escluso F, diminuisce: ciò comporta un progressivo indebolimento del legame ed una conseguente maggiore facilità di rottura di esso. Anche negli acidi alogenidrici aumenta la distanza e diminuisce l'energia: infatti HI è acido molto più forte di HF.
In generale, a maggiore ordine di legame corrisponde maggiore energia di legame e minore distanza.
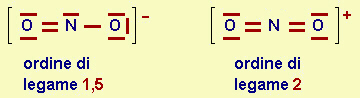
Come abbiamo visto nel caso di NO, ci possono essere anche legami di ordine non intero (per esempio 1.5 per NO-, mentre è 2 per NO+, come è evidenziabile con le formule limite.
| Fig.16.3 Formule
limite per il diossido di azoto La formula limite rappresentata nel primo caso ne prevede, ovviamente, un'altra simmetrica, in situazione mesomerica o di risonanza con la prima. Altre formule limite sono possibili, ma, essendo meno probabili, contribuiscono meno alla struttura reale. |
 |
Viene definito come raggio covalente la metà della distanza di legame fra due atomi eguali.
La differenza fra il valore che si otterrebbe sommando i due raggi covalenti di due atomi diversi, rispetto alla distanza reale, si può imputare alla percentuale di ionicità del legame.
Questo è evidente dalla figura 16.2: il raggio covalente espresso in pm per H è 37 (la metà di 74), per F è 46, per I è 133,5, per N 73,5, per C 77.
Se si esaminano i legami tra atomi diversi (gli ultimi della tabella), si può notare che la distanza di legame è diversa dalla somma dei raggi covalenti; la differenza dà un'idea della ionicità del legame.
| legami | distanza di legame reale | somma raggi covalenti |
| H-F | 92 | 83 |
| H-I | 161 | 170,5 |
| NH3 | 101 | 110,5 |
| CH4 | 109 | 114 |
Fig.16.4 Esempi di legami con corrispondenti distanza di legame e somma teorica dei raggi covalenti
Esistono anche altri tipi di legame non facilmente inquadrabili nei modelli di legame covalente o ionico o, comunque tanto caratteristici da poter essere trattati come un modello a parte.
Legame coordinativo: è un legame covalente in cui i due elettroni di legame sono forniti dall'atomo donatore: la nuvola elettronica è perciò polarizzata verso l'atomo donatore.
Legame di idrogeno: è dovuto a interazione di atomi H legati ad atomi elettronegativi, con atomi analoghi di altre molecole.
E' causa, per esempio, della elevata temperatura di ebollizione dell'acqua alla pressione di una atmosfera (Teb=100°C); infatti, dato il suo piccolo peso molecolare (p.m.18), essa dovrebbe essere addirittura gassosa a temperatura ambiente, come lo sono, per esempio, NH3 (p.m.17), CH4 (p.m.16); HF (p.m.20, ha Teb circa 20°C, ma è in forma dimera, cioè H2F2). L'omologo superiore (l'atomo che, nella tavola periodica, si trova sotto un altro, nello stesso gruppo) dell'O, lo zolfo S, dà H2S (p.m.34) che pure ha Teb<-50°C; HCl (p.m.36,5) è ancora gassoso.
Praticamente l'acqua liquida è tale perché esistono infiniti legami di idrogeno tra gli H e gli O; il fenomeno è dovuto al fatto che, essendo O molto elettronegativo, gli H ad esso legati hanno una parziale carica positiva, che tendono a compensare interagendo con i doppietti liberi degli O di altre molecole: ogni O è praticamente legato parzialmente a 4 H, in una struttura pressoché tetraedrica. Per NH3 il fenomeno incide poco; per CH4 non conta nulla (infatti C è poco elettronegativo rispetto ad H).
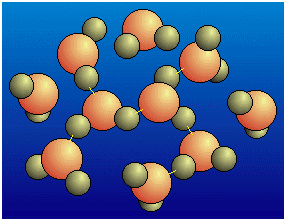
| Fig.16.5 I
legami intermolecolari a idrogeno nell'acqua sono evidenziati mediante i trattini gialli;
sono dovuti alla interazione elettrostatica tra atomi di ossigeno e atomi di idrogeno di
molecole di acqua vicine tra loro. Si creano così legami parziali tra O e H di molecole diverse. Le conseguenze sono, da una parte, l'allentamento di legami preesistenti, schematizzato nella figura successiva; dall'altra, la formazione dinamica (che si modifica cioè continuamente) di agglomerati di molecole di acqua che giustificano l'alto punto di ebollizione: è come se si trattasse non di singole molecole, ma di un "polimero" con peso molecolare molto più alto di quello della molecola H2O. |
|
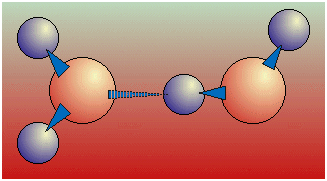
| Fig.16.6 Allentamento
di legami nell'acqua. Il legame di un idrogeno con un altro ossigeno fa allentare i legami preesistenti a causa della sottrazione di carica elettronica, tanto che l'H può staccarsi dall'O cui era legato e legarsi ad un altro. La situazione dinamica con formazione e distruzione continua di legami e conseguente scambio di H da una molecola all'altra è stato confermato introducendo acqua pesante D2O (in cui D rappresenta l'isotopo 2 di H, chiamato deuterio) in H2O: in tempi brevissimi D è distribuito statisticamente tra tutte le molecole presenti. |
 |
Legami più deboli possono esssere dovuti a polarizzazioni moderate, come quelle dovute alle deboli forze di dispersione di London, che portano a dipoli indotti, cioè dipoli che si creano, in una molecola non dipolare, a causa di interazioni con molecole vicine che possiedono dipoli permanenti; oppure a quelle dovute a interazione per orientazione o per induzione. Tutte queste forze sono dette forze di Van der Waals.
Legame metallico: il modello che rende conto delle caratteristiche di conducibilità elettrica è quello di un sistema reticolare di cationi immerso in un mare di elettroni mobili, liberi di muoversi; è assimilabile perciò ad una situazione estrema di risonanza.
A livello un po' più approfondito, si può pensare a un sistema di orbitali di legame e di antilegame delocalizzati sull'intero cristallo del metallo. Queste due serie di orbitali costituiscono delle bande; quella superiore, di antilegame, è ad energia di poco più alta, perciò è possibile che vengano facilmente utilizzati orbitali di antilegame per la conduzione, cioè per lo spostamento di elettroni in quanto la spesa di energia è molto bassa.
Possiamo ricapitolare i vari tipi di forze chimiche che giustificano la struttura e il comportamento della materia, menzionandole in ordine di forza all'incirca decrescente:
• legame covalente, molto forte e direzionale, agisce a distanza breve; E » 70÷100 kcal/mole
• legame ionico, molto forte, non direzionale, E = z+z-/r diminuisce in funzione inversa alla distanza r
• interazione ione-dipolo, più debole del legame ionico (sono coinvolte cariche frazionarie) ma con caratteristiche simili
• legame a idrogeno
• interazioni dipolo-dipolo, abbastanza debole, non direzionale; diminuisce con 1/r3
• interazioni ione-dipolo indotto, debole, cala con 1/r4
• interazione dipolo-dipolo indotto, molto debole, cala con 1/r6
• interazione dipolo istantaneo-dipolo indotto (forze di London) molto debole, cala con 1/r6
• forze repulsive: variano in funzione di 1/rn con n=5÷12.