Corso di chimica generale ed inorganica 17 - le isomerie Abbiamo visto finora, in modo sintetico,
le caratteristiche del legame chimico. Ma per sapere qualcosa di più sulle molecole
e sulla loro struttura considereremo brevemente alcune loro specifiche
caratteristiche, strettamente legate alle loro proprietà chimico-fisiche,
in particolare: - composizione - costituzione - configurazione - conformazione. Esamineremo alcuni casi che ci
permetteranno di trattare le prime tre di queste caratteristiche. Fig.17.1 Esempi di molecole con
formula minima eguale. Di queste, sono: isomeri di composizione
(stessa formula minima) (a, b, c); (d, e, f, g, h, i, l, m, ) isomeri di costituzione
(stessa formula molecolare) (e, f, g );(h, i, l, m) isomeri di configurazione
(stessa formula di struttura) (h, l, m) Le formule di
struttura delle molecole indicate con * sono rappresentate nella figura seguente. I due tratti diagonali sulla seconda molecola
rappresentano i due metili. COMPOSIZIONE: è data dai tipi di atomi che costituiscono
le molecole (si può ottenere mediante analisi
elementare qualitativa della sostanza) e
dal loro rapporto numerico
nome
formula
minima
formula
molecolare
formula di
struttura
a
acetilene
CH
C2H2
H-CºC-H
b
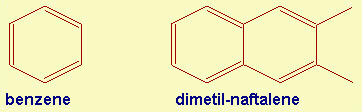
benzene
CH
C6H6
aromatica con
un anello *
c
dimetilnaftalene
CH
C12H12
aromatica con
due anelli *
d
formaldeide
CH2O
CH2O
H2C=O
e
acido
acetico
CH2O
C2H4O2
CH3COOH
f
formiato di
metile
CH2O
C2H4O2
HCOOCH3
g
aldeide
glicolica
CH2O
C2H4O2
HCO-CH2OH
h
glucosio
CH2O
C6H12O6
HCO-(CHOH)4-CH2OH
i
fruttosio
CH2O
C6H12O6
HOCH2-CO-(CHOH)3-CH2OH
l
mannosio
CH2O
C6H12O6
HCO-(CHOH)4-CH2OH
m
gulosio
CH2O
C6H12O6
HCO-(CHOH)4-CH2OH
Fig.17.2
Rappresentazione convenzionale delle molecole di benzene e di dimetilnaftalene.
Attraverso queste analisi si ottiene la formula minima, che può essere comune a più composti. Per esempio, sono isomeri di composizione, tra quelli indicati nella figura 17.1, (a, b, c) oppure (d, e, f, g, h, i, l, m).
E' evidente che occorre perciò conoscere almeno il peso molecolare, per sapere qualcosa di più sulla molecola.
COSTITUZIONE: indica come sono legati gli atomi; e, f, g, per esempio, hanno stessa formula molecolare (stesso peso molecolare, oltre che stessa formula minima), ma hanno gli atomi legati in modo diverso; perciò hanno diverse proprietà chimiche e fisiche; sono detti isomeri di costituzione.
CONFIGURAZIONE: indica la reciproca posizione degli atomi nello spazio.
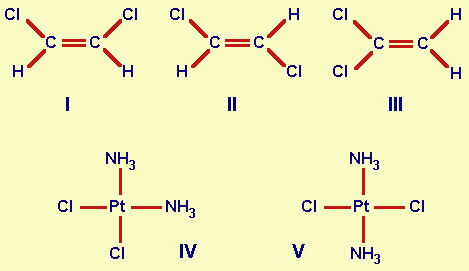
Per esempio sono isomeri di configurazione il cis e il trans-dicloroetilene e il cis e il trans-diammino dicloro platino (II); (il simbolo II per Pt sta ad indicare lo stato di ossidazione 2).
| Fig.17.3
Esempi di isomeri di configurazione:
I e II, sono rispettivamente cis- e trans-1,2 dicloro etilene.
Notare che la molecola III, 1,1 dicloro etilene, non è un isomero di configurazione rispetto a I e II, bensì un isomero di costituzione.
IV e V, sono rispettivamente cis- e trans-diammino dicloro Pt (II). |
 |
Un altro tipo di isomeria configurazionale è quella degli zuccheri.
Nella figura seguente viene data una rappresentazione convenzionale (nel senso che è accettata per convenzione internazionale) planare di molecole di zuccheri diversi.
| Fig.17.4
Esempi di isomeria di alcune molecole di zuccheri esosi (cioè con 6 atomi di C). Questi sono solo alcuni dei 16 possibili isomeri.
Solo i primi 3 sono isomeri di configurazione; in effetti il D(-) fruttosio non è un isomero di configurazione bensì di costituzione, dato che i primi due C hanno sostituenti diversi, non solo diversamente orientati. |
 |
L'isomeria di configurazione vista per gli zuccheri è dovuta al fatto che i 4 C centrali sono asimmetrici poiché i 4 sostituenti di ogni carbonio sono diversi.
Van't Hoff, olandese, fu uno dei chimici più geniali e si può considerare un po' il padre della stereochimica
| Fig.17.5
J.H.van't Hoff (1852-1921)Van't Hoff, Jacobus
Hendricus (Rotterdam 1852 - 1911), chimico-fisico olandese, noto per i suoi studi
sulla struttura dei composti organici.
Nel 1876 divenne docente di fisica presso la scuola veterinaria di Utrecht e nel 1878 professore di chimica, mineralogia e geologia all’università di Amsterdam. Professore di chimica a Lipsia nel 1887 e a Berlino nel 1896. E' spesso definito il padre della chimica fisica e raggiunse assai giovane (a soli 22 anni!) eccellenti risultati quando, nel 1874, enunciò una teoria che illustrava la struttura dei composti organici. Il rapporto da lui determinato tra i composti del carbonio otticamente attivo e le strutture asimmetriche e tridimensionali posero le basi della stereochimica. Nel 1901 fu insignito del primo premio Nobel per la chimica, per le sue ricerche che mettevano in relazione la termodinamica alle reazioni chimiche, e gli studi sulle proprietà delle soluzioni. (da Enciclopedia Microsoft Encarta) |
 |
L'ipotesi della struttura tetraedrica del carbonio fu posta contemporaneamente anche da J.Le Bell (1847-1930), ma fu merito di van't Hoff di diffonderla nella comunità dei chimici europei.
Egli infatti costruì dei modellini in cartone per dimostrare le sue asserzioni e li inviò a una ventina dei più famosi chimici (allegando anche una piccola guida per costruirli usando forbici e colla).
La sua ipotesi fu accolta con entusiasmo da alcuni di essi, mentre altri (come spesso succede nella storia della scienza) vi si opposero tenacemente. Ma la sua teoria si affermò presto.
| Fig.17.6
Atomo di C asimmetrico La struttura spaziale è tetraedrica; a, b, c, d rappresentano possibili sostituenti degli H della molecola di metano. Se i quattro sostituenti sono tutti diversi tra loro, allora C è asimmetrico, cioè una sua immagine speculare non è sovrapponibile a quella originaria. |
 |
Questa isomeria si chiama, se dovuta ad atomi asimmetrici, isomeria ottica e gli isomeri sono detti isomeri ottici o enantiòmeri (dal greco enantios = contrario, opposto).
Alcuni di questi possono essere attivi otticamente: sono in grado di ruotare il piano di polarizzazione della luce di angoli positivi o negativi e ciò è indicato dai simboli (+) e (-); l'effetto ottico è dovuto ai contributi dei singoli atomi di C asimmetrico, perciò può capitare che gli effetti dei C della molecola si compensino a vicenda (si parla di isomeri ottici con compensazione interna); in tal caso, nonostante la presenza di C asimmetrici, non si avrebbe nessun effetto di polarizzazione della luce. Lo stesso accade se sono presenti in eguale percentuale (50%) i due isomeri ottici opposti; in questo caso si parla di miscele racéme.
CONFORMAZIONE: indica come sono posizionati gli atomi rispetto al resto della molecola.
Prendiamo per esempio, la molecola 1,2-dicloro etano, di formula molecolare Cl H2C-CH2 Cl.
Se la guardiamo lungo l'asse del legame carbonio-carbonio, la molecola può assumere varie posizioni, ruotando un C rispetto all'altro attorno a quest'asse.
Le varie situazioni ottenibili sono detti confòrmeri.
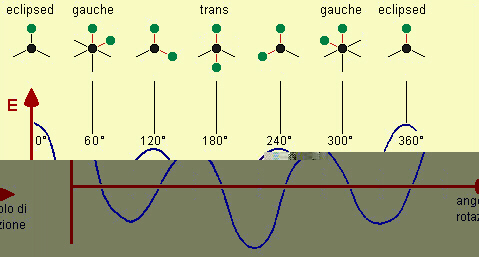
| Fig.17.7
Conformeri della molecola di 1,2-dicloro etano e relativa energia. Sono indicate le posizioni successive dei due Cl (in verde) per rotazione di 60° rispetto alla precedente, fino a raggiungere, dopo 360°, la posizione iniziale eclipsed (nascosto, poiché i due sostituenti ingombranti, i Cl, molto più grandi di H, sono uno dietro l'altro). Le conformazioni gauche e trans sono dette "sfalsate". In corrispondenza ad ogni rotazione è indicata l'energia del sistema; la curva che rappresenta la variazione di energia al variare della rotazione è una sinusoidale asimmetrica. La conformazione trans è la più stabile perché comporta la minima repulsione elettronica fra i due Cl, mentre la meno stabile è la eclipsed. |
 |
Di solito non è possibile separare questi confòrmeri poiché, essendo piccola la DE, la molecola è in continua rotazione molto veloce (circa 106 ÷ 107 volte/secondo); solo se i gruppi sostituenti sono molto ingombranti la rotazione sarà più difficile o, addirittura, impedita (come nel caso che invece di Cl ci sia Br o I).
Abbiamo visto, così, che per individuare una molecola (e le sue carattristiche chimico-fisiche), non basta conoscere la formula minima, nemmeno la molecolare, talvolta.
Abbiamo anche avuto una pallida idea della stereochimica, una branca importantissima della chimica.
In questo settore esiste, per esempio, l'analisi conformazionale, cioè l'analisi delle proprietà fisiche e chimiche della molecola in base alla geometria delle diverse conformazioni in cui essa può esistere; le interazioni considerate sono quelle tra atomi non direttamente legati tra loro (mentre le configurazioni esistono a causa dei legami di valenza).
Si può dire che essa sia nata circa nel 1890, quando H.Sachse ipotizzò l’esistenza, per il cicloesano di due diverse conformazioni, "a sedia" e "a vasca". Il passaggio da una conformazione all'altra è possibile con relativamente piccole variazioni di energia.
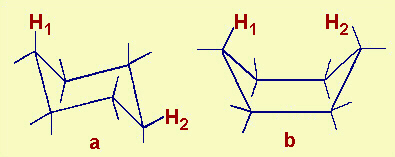
| Fig.17.8
Conformazione a sedia (a) e a vasca (b) per la molecola di cicloesano; ogni trattino
rivolto verso l'esterno indica un legame CH. E' evidente che esistono interazioni diverse fra i vari H a seconda della conformazione (per esempio H1 e H2 saranno soggetti a repulsione elettronica maggiore nel caso b); perciò la conformazione a vasca sarà ad energia maggiore di quella a sedia, a, in cui i legami CH sono o paralleli al legame C-H1 o diretti radialmente verso l'esterno come C-H2. |
 |
 |
Fig.17.9
Un'altra rappresentazione, mediante modellini molecolari, delle conformazioni a sedia (a
sinistra) e a vasca (a destra) per il cicloesano Sono evidenti le direzioni dei legami carbonio-idrogeno e perciò le interazioni tra gli H |
 |
Altre caratteristiche, legate però alla struttura dei solidi (si considera cioè un livello macroscopico, nel quale sono coinvolte molte molecole) sono il polimorfismo, fenomeno per cui un composto può cristallizzare, in condizioni diverse, sotto due o più forme diverse.
Per esempio, ZnS può avere la struttura della blenda o della wurtzite; anche C può presentarsi con la struttura del diamante o con quella della grafite. In particolare, poiché in quest'ultimo caso si tratta di una sostanza elementare, si parla di allotropìa. Altri casi di allotropia sono presentati, per esempio, da P e da As.