Corso di chimica generale ed inorganica 29 - le proprietà colligative Parlando di soluzioni binarie
solido-liquido, possiamo introdurre le proprietà colligative delle soluzioni,
proprietà che ci permettono di risolvere un problema importantissimo, quello della determinazione
sperimentale del peso molecolare. Determinare il peso molecolare di una
sostanza è una delle fasi fondamentali per conoscerne le caratteristiche chimico-fisiche
(benché spesso anche questo non sia sufficiente); è infatti essenziale conoscere almeno
la formula molecolare di un composto. Fino all'avvento dello spettrometro di massa (strumento comunque
molto sofisticato e costoso) gli unici metodi per farlo si basavano sulle proprietà
colligative, cioè su proprietà delle soluzioni che dipendono solo dal numero di
particelle di soluto e non dalla loro natura. Sappiamo dalla legge
di Raoult (pi = ci pi°) che, in una
soluzione di un soluto non volatile, la tensione di vapore pi è
proporzionale alla ci e alla tensione di vapore del
solvente puro pi°.
E' chiaro perciò che la p dipende dalla natura del solvente (pi°) ma non da quella del soluto: per il soluto, infatti, conta solo il numero di moli csoluto = 1 - csolvente
Se chiamiamo csoluto = c2 allora p = p° (1-c2) da cui
p°-p = p° c2 e (p°-p)/p° = c2
Possiamo esprimere questa relazione dicendo che "l'abbassamento relativo della tensione di vapore di una soluzione è numericamente uguale alla frazione molare del soluto".
La relazione è valida per soluzioni diluite: solo in questo caso sono trascurabili le deviazioni cui è soggetta la legge di Raoult con soluzioni reali.
Questa variazione di p si accompagna anche a variazioni dei punti di congelamento e di ebollizione.
Infatti il diagramma di stato del solvente, in presenza di un solido poco volatile, viene modificato, creando un nuovo punto triplo.
Anche i punti di fusione e di ebollizione della soluzione cambiano rispetto ai valori standard (T°f e T°e) del solvente:
Tf subisce un abbassamento DTf, mentre Te subisce un innalzamento DTe.
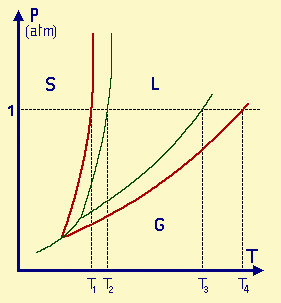
| Fig.29.1
Diagramma di stato del solvente in presenza di un soluto poco volatile. Il nuovo punto triplo è quello in cui si incrociano le curve rosse con la verde. Le curve relative all'equilibrio L-S e L-G per la soluzione sono rispettivamente più a sinistra e più in basso di quelle per il solvente. Il valore 1 corrisponde alla pressione di 1 atmosfera e i valori intercettati sulle curve danno perciò i punti di fusione e di ebollizione del solvente e della soluzione; in particolare: T2 e T3 corrispondono rispettivamente alle temperature di fusione e di ebollizione del solvente puro; T1 e T4 corrispondono rispettivamente alle temperature di fusione e di ebollizione della soluzione. Sono evidenti le variazioni delle temperature di fusione (DTf = T2-T1) e di ebollizione (DTe = T4-T3) della soluzione rispetto a quelle del solvente puro. |
 |
Le variazioni del punto di fusione e del punto di ebollizione seguono due leggi analoghe
DTf = T2-T1 = Kf m DTe = T4-T3 = Ke m
in cui:
DTf = abbassamento crioscopico
DTe = innalzamento ebullioscopico
Kf = costante crioscopica molale
Ke = costante ebullioscopica molale
m = molalità della soluzione, definita come il numero di moli di soluto ogni 1000 grammi di solvente puro.
Se in una soluzione esistono più soluti poco volatili, la molalità si ottiene sommando le molalità dei singoli soluti.
Se uno dei soluti si dissocia (o, più raramente, si associa), occorre tenere presente che, poiché quello che conta è il numero di particelle, occorrerà valutare, nella molalità, anche il contributo dovuto a questi fenomeni.
Il valore numerico delle costanti K, per i vari solventi, è diverso e dipende dalla natura del solvente stesso.
La scelta del solvente è perciò molto importante per ottenere variazioni misurabili dei punti di ebollizione e di fusione; infatti, quanto più alta è la costante, tanto più alto sarà l'effetto, a parità di molalità; purtroppo non sempre è possibile scegliere il solvente con K elevata, perché potrebbe essere, per un dato soluto, poco adatto come solvente.
Come esempio vengono riportate le temperature di ebollizione e di fusione di alcuni solventi e le relative K.
solvente |
nome convenzionale | Te° |
Ke |
Tf° |
Kf |
H2O |
acqua | 100,0 |
0,512 |
0,00 |
1,86 |
CH3COCH3 |
acetone | 56,5 |
1,73 |
- |
- |
C2H5OH |
etanolo | 78,5 |
1,22 |
-117,3 |
1,99 |
CH3COOH |
acido acetico | 118,9 |
3,10 |
16,6 |
3,90 |
C6H6 |
benzene | 80,1 |
2,53 |
5,5 |
4,90 |
CHCl3 |
cloroformio | 61,2 |
3,63 |
- |
- |
(C2H5)2O |
etere etilico | 34,5 |
1,19 |
- |
- |
C6H5NO2 |
nitrobenzene | - |
- |
5,7 |
6,90 |
C6H12 |
cicloesano | 80,7 |
2,69 |
6,5 |
20,0 |
canfora |
canfora | - |
- |
178,4 |
37,7 |
Fig.29.2 Costanti crioscopiche ed ebullioscopiche per i solventi più comunemente usati nelle determinazione del peso molecolare e relative temperature di fusione e di ebollizione.
Le relazioni ebullioscopica e crioscopica sono valide rigorosamente solo per soluzioni diluite (che obbediscano, cioè, alla legge di Raoult); è ovvia perciò la necessità di termometri ad altissima precisione, visto che le K sono molali e rappresentano il DT per una molalità m = 1!
Tanto per fare un esempio, se il soluto avesse un peso molecolare uguale a 1000, per avere una soluzione con molalità m = 1 (per poter misurare cioè un DT uguale alla K), occorrerebbe scioglierne 1000 g in 1000 g di solvente puro! Se poi si tratta di molecole di interesse biologico, come le proteine, si pensi che queste possono raggiungere facilmente pesi molecolari superiori a 100.000!
Queste proprietà si possono considerare come dovute alla difficoltà del soluto a passare dalla fase soluzione ad un'altra fase in quelle condizioni.
Questo concetto di "difficoltà" compare anche in un'altra proprietà colligativa, la pressione osmotica P.
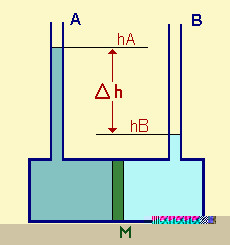
| Fig.29.3
Schema che rappresenta il fenomeno della pressione osmotica. La soluzione (a sinistra, di colore più intenso) e il solvente puro (a destra) sono separati da una membrana semipermeabile M, che lascia passare le molecole di solvente, ma non quelle del soluto. All'inizio il livello dei liquidi nei due vasi A e B è lo stesso; dopo un certo tempo il livello di A si stabilizza ad h = hA, in B ad h = hB. Il dislivello Dh = hA - hB corrisponde ad una pressione idrostatica che è eguale alla pressione osmotica P (pi greco) della soluzione. La relazione è P = c R T In cui c è la concentrazione della soluzione, R è la costante universale dei gas, e T è la temperatura assoluta. |
 |
All'inizio, a causa di P, il numero di molecole di solvente che attraversa la membrana al secondo, da destra a sinistra, è maggiore di quello delle molecole che passano da sinistra a destra.
La differenza dei flussi diminuisce al crescere del Dh, finché la pressione idrostatica non è in grado di controbilanciare P.
La legge è simile alla legge generale dei gas; basta ricordare che la concentrazione è definita come numero di moli in un dato volume: c = n/V; R infatti ha lo stesso valore (0,082 atm dm3 mol-1 K-1).
Le proprietà osmotiche sono importanti nei fenomeni biologici: tutte le cellule sono circoscritte da membrane semipermeabili, attraverso le quali passano molecole o ioni piccoli, ma non le proteine.
Alcune membrane biologiche sono estremamente selettive, tanto da poter discriminare, per esempio, tra ioni Na+ (0,97 Å) e ioni K+ (1,33 Å).
Sono ovviamente importanti anche nel campo medico: per esempio, quando si effettua una fleboclisi (immissione di soluzioni nutritive o medicinali nel sangue), è necessario che la soluzione sia isotonica (cioè con la stessa P) con quella del sangue; se essa fosse ipotonica (minore P per la soluzione), il solvente tenderebbe a penetrare nelle cellule fino anche alla rottura della membrana; se invece fosse ipertonica (P maggiore), il solvente uscirebbe dalle cellule, facendole raggrinzire e contrarre fino ad impedirne l'attività.
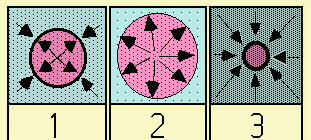
| Fig.29.4
Rappresentazione schematica degli effetti subiti da una cellula immersa in soluzioni
isotonica (1), ipotonica (2), ipertonica (3). Le freccette rappresentano le direzioni delle forze che agiscono sulla membrana della cellula. Nel primo caso (soluzione isotonica) quelle esterne e quelle interne sono bilanciate; nel secondo caso (soluzione ipotonica) predominano quelle interne, con aumento del volume della cellula; nel terzo caso (soluzione ipertonica) predominano quelle esterne, con riduzione del volume. |
 |
Gli stessi concetti si applicano anche nella dialisi attuata, per esempio, col rene artificiale.
I reni purificano il sangue dalle scorie del metabolismo; se i reni non funzionano, questi rifiuti possono portare anche alla morte (per blocco renale). Si può perciò purificare il sangue mediante circolazione extracorporea attraverso un condotto semipermeabile (per esempio cellophan) immerso in una soluzione adeguata. Nella soluzione (dializzato), passano, dal sangue, solo i rifiuti metabolici (cataboliti), come l'urea. Per evitare un depauperamento, per esempio degli ioni Na+ e K+, o un loro sbilanciamento (che può essere pericoloso per la pressione sanguigna) è necessario che la soluzione abbia la stessa molalità in Na+ e K+ del sangue e che sia isotonica.
Se i soluti subiscono dissociazione, l'effetto cambia. Se si tratta di elettroliti forti, dobbiamo semplicemente considerare un effetto proporzionale (per NaCl 10-3 M in H2O, l'effetto sarà proporzionale a 2 x 10-3 M).
Il problema è più complesso se abbiamo elettroliti deboli. Consideriamo, per esempio, un acido organico, come l'acido acetico CH3COOH, che chiamiamo AcH per semplicità. Questo acido organico debole si dissocia:
H Ac ¨ H+ + Ac-
Se chiamiamo a il grado di dissociazione dell'acido, n il numero di particelle generate dalla dissociazione, n0 il numero di moli iniziali di AcH, il numero di particelle complessivo n, sarà:
n = (n0 - n0 a) + 2 n0 a = n0 (1 + a)
e, in generale,
n = (n0 - n0 a) + n n0 a = n0 (1 - a + n a) = n0 [1 + (n - 1) a]
Nel caso di misure ebullioscopiche o crisocopiche i DT saranno perciò maggiori del previsto:
DT = K m [1 + (n - 1) a]
Per la stessa ragione, in caso di misure della pressione osmotica occorrerà tenere conto dell'aumento del numero di particelle effettive.
Per alcuni soluti è possibile che ci sia associazione, con una conseguente diminuzione del numero di particelle, perciò della molalità; il fenomeno si presenta spesso quando un soluto polare (come un acido organico), se sciolto in solvente apolare, può dare luogo a legami di idrogeno intermolecolari.
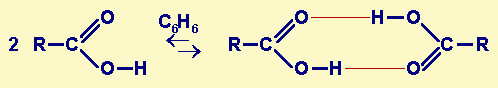
| Fig.29.5 Schema
di reazione di associazione di due molecole di un acido organico in un solvente apolare
come il benzene; praticamente l'effetto sulla molalità è quello di ridurre a metà il
suo valore, anche se, come la dissociazione di un acido debole è parziale, anche
l'associazione lo è. In rosso sono evidenziati i legami di idrogeno che causano l'associazione. |
 |
Da misure relative alle proprietà colligative delle soluzioni è possibile perciò determinare:
• peso molecolare del soluto
• grado di dissociazione o di associazione di un acido
I metodi di misura legati alle proprietà colligative sono delicati nell'attuazione e nel rilevamento dei dati sperimentali; ma il problema è meno drammatico di quanto sembri: infatti, quando si vuole determinare il peso molecolare di una sostanza, di cui si conosca, ovviamente, la formula minima, basterà sapere che rapporto c'è tra la formula molecolare e la formula minima e questo può essere solo un multiplo intero; non occorre perciò avere il valore preciso del peso molecolare.