Corso di chimica generale ed inorganica 30 - gli equilibri solido-liquido Gli equilibri tra sistemi in fasi
condensate sono importanti in particolare nello studio delle leghe metalliche e
della cristallizzazione frazionata, tecnica molto usata dai chimici per purificare le
sostanze. Consideriamo gli equilibri
solido-liquido; generalmente si opera a pressione costante, perciò i
diagrammi avranno in ordinata la temperatura. Vediamo dapprima il caso di un sistema
binario A-B in cui A e B sono immiscibili allo stato solido, dato che si tratta
di un caso abbastanza comune. Partiamo da un liquido di composizione c1 Il diagramma riporta, in ascissa, la composizione, espressa con le
frazioni molari; in ordinata la temperatura T, dato che si opera a pressione costante. Si ricordi che i punti delle aree in
grigio non hanno esistenza fisica (si ha smistamento nelle fasi solida e liquida). A destra la curva di raffreddamento o analisi
termica del processo di solidificazione, analisi essenziale per individuare le
caratteristiche del sistema (e per costruire il diagramma di stato). Il grafico riporta, in ordinata, le
temperature T nella stessa scala del diagramma a sinistra; in ascissa i tempi t. Raffreddando la soluzione di composizione c1, alla temperatura T
= T1 inizia a
cristallizzare A puro, al tempo t1; il liquido si
impoverisce in A, perciò la sua composizione c si muove verso
destra, lungo la curva TA-E. Di conseguenza la
T di solidificazione diminuisce. Applicando la regola delle
fasi, possiamo notare che il sistema, da trivariante quando è tutto in fase
liquida L (v = 2 + 2 - 1; variabili possibili p, T, c), diventa
bivariante (v = 2 + 2 - 2): poiché la pressione è costante, ad una data composizione
corrisponde una sola temperatura di fusione Tf. Quando si arriva al punto
eutettico E, al tempo t2, la soluzione satura, di
composizione cE, cristallizza tutta come A
puro e B puro, alla temperatura T = TE.
Fig.30.1
Diagramma di stato di un sistema binario A-B in cui A e B sono immiscibili allo stato
solido, con formazione di un eutettico.
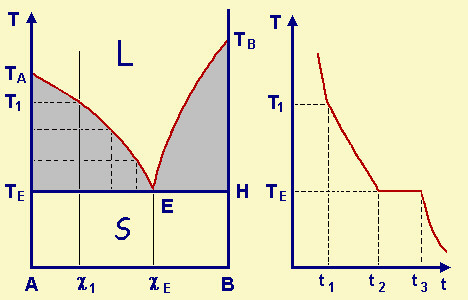
Il sistema è monovariante (v = 2 + 2 - 3) fino al tempo t3, (ma poiché p=cost., l'unica variabile è già fissata);
dopo t3 il sistema, tutto solido, può continuare a raffreddarsi, poiché ridiventa bivariante (v = 2 + 2 - 2); le due fasi sono ora A puro e B puro.
Se fossimo partiti da una soluzione liquida di composizione cE, che è detta eutettica, la solidificazione sarebbe avvenuta tutta a T = TE, come se si fosse trattato di un composto puro, ma A e B cristallizzano separatamente e danno luogo perciò a due fasi.
TE è detta temperatura eutettica; E è detto punto eutettico.
All'interno dei triangoloidi TAETE e TBEH il sistema è praticamente monovariante (v = 2 + 2 - 2, ma ricordiamo che p=cost.) la composizione della fase solida non è variabile, in quanto si tratta di un solido puro. Occorre ricordare anche che i punti all'interno dei triangoloidi non hanno significato reale, in quanto il sistema si smista in un solido puro (A o B rispettivamente) e in una fase liquida.
Alcune miscele eutettiche acqua/sale vengono usate come miscele frigorifere per la loro proprietà di congelare a T costante (cioè a T = TE)
| soluto S | concentrazione (gr.S/100 gr.H2O) | TE (°C) |
| KCl | 24,5 | -10,7 |
| NH4NO3 | 60 | -13,6 |
| NH4Cl | 20 | -15,4 |
| NaCl | 35 | -21,3 |
| MgCl2 | 21 | -33,0 |
| CaCl2 | 48 | -51,0 |
Fig.30.2 Dati caratteristici di alcune miscele frigorifere e loro punti eutettici; la concentrazione è quella della miscela eutettica.
Per esempio CaCl2, che ha una TE molto bassa, viene usato correntemente per evitare la formazione di ghiaccio sulle strade o per scioglierlo, abbassandone la T di fusione (il suo uso abituale è dovuto anche al suo basso costo di produzione).
Esaminiamo il comportamento di un sistema di questo genere per comprenderne il meccanismo.
Condizioni iniziali: p = cost.; T ambiente.
Mescoliamo ghiaccio tritato e un sale (p.e. NaCl). Il sale si scioglie, in parte, nella poca acqua liquida; ora abbiamo tre fasi: H2O (s), NaCl (s), soluzione;
perciò v = 2 + 2 - 3 = 1
le tre fasi possono coesistere solo a T = TE (-21,3°C) dato che la p è già fissata.
Allora, o la T ambiente arriva ad assumere il valore TE, oppure deve scomparire una delle fasi, in modo che il sistema riacquisti un ulteriore grado di libertà: il ghiaccio fonde e scioglie NaCl; poiché la fusione è un processo endotermico (come pure, di solito, la dissoluzione) la T ambiente diminuisce.
Se le quantità di sale e di ghiaccio sono sufficienti, il ghiaccio fonde fino a che T = TE. A questo punto le condizioni di equilibrio sono soddisfatte: il sistema resta a questa T finché non ha sottratto all'ambiente abbastanza calore da fondere tutto il ghiaccio o da sciogliere tutto il sale; solo allora, dato che scompare una delle fasi solide, il sistema può variare la sua T, che tenderà ad assumere, in un certo tempo, il valore della T ambiente.
Oltre a questo esempio di sistemi con eutettico, molti altri ne esistono, in particolare tra le leghe metalliche: sono sistemi con eutettico, per esempio, le coppie Pb/Ag, Si/Al, Bi/Cd, Pb/Sb, Bi/Cu, Si/Au, oppure altri sistemi come KCl/AgCl, C6H6/CH3Cl etc.
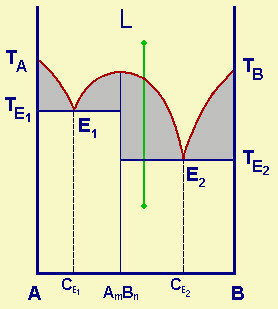
In altri casi, come nelle leghe Al/Mg, Au/Sn, Zn/Mg e altre, si può formare un composto intermetallico AmBn, con punto di fusione definito.
Per esempio, tra Al e Mg si forma Al3Mg4, che fonde alla temperatura di 463°C.
| Fig.30.3
Diagramma isobaro di stato di una lega binaria con formazione di composto
intermetallico di composizione AmBn.
Si può considerare come la giustapposizione di due diagrammi di stato con eutettici E1 ed E2 ed è possibile trattare il sistema globale come quello semplice con un solo eutettico, a seconda della composizione della miscela. Per esempio, se la composizione della miscela si trova tra quella del composto AmBn e quella del secondo eutettico E2, (tratto in verde) si utilizzerà solo la parte a destra del diagramma: si formerà dapprima solo AmBn; quando si raggiungerà la TE2, cristallizzeranno separatamente i due solidi AmBn e B. Il primo sistema è perciò costituito solo dai due componenti A e AmBn; il secondo solo dai due componenti AmBn e B. |
 |
Un altro caso si ha quando un solido ha due forme cristalline enantiòtrope (che possono, cioè, trasformarsi reversibilmente l'una nell'altra a seconda della temperatura) che possiamo chiamare a e b.
Questo comporta un punto di transizione G tra le due forme cristalline.
| Fig.30.4
Diagramma di stato per un sistema con un punto di transizione tra due
forme cristalline della specie B. La cristallizzazione inizia a T = T1, con la separazione della fase B(a); la composizione del liquido si sposta lungo la curva TBG; al punto di transizione G, perché T possa diminuire, è necessario che la forma a diventi b, poiché, a T<TG essa non è più stabile. Inoltre, per la regola delle fasi, non possono coesistere 3 fasi (liquido, a,b) se non al punto G che, essendo p=cost., è invariante. Procedendo nel raffreddamento, il sistema è perfettamente analogo a quello con eutettico E. |
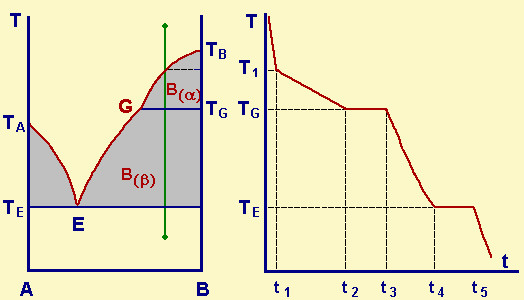 |
L'analisi termica del processo di raffreddamento per la miscela presa in considerazione, dà il grafico a destra in cui, al tempo t1 la miscela (T = T1) inizia a separare B(a); al tempo t2 raggiunge T = TG, corrispondente al liquido di composizione G: a questo punto inizia la transizione a ® b, che termina al tempo t3. Da t3 a t4 si separa B(b); ma a t4, T = TE; siamo all'eutettico: la soluzione rimanente solidifica tutta a T = TE.
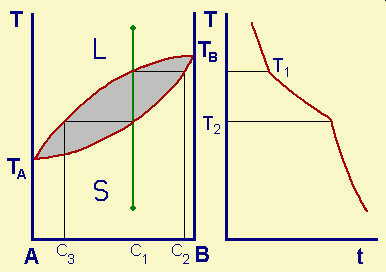
Esistono anche coppie di sostanze che, anche in fase solida, sono completamente miscibili: si ottengono cristalli misti (nel caso di coppie metalliche, una lega); la solidificazione avviene gradualmente senza arresto della temperatura, ma con variazioni di pendenza come si vede nell'analisi termica del processo.
| Fig.30.5
Diagramma di stato per un sistema binario A-B con formazione di cristalli
misti. All'interno della lente (in cui i punti si smistano in una fase liquida in equilibrio con una fase solida), quando cioè sono presenti due fasi, il sistema è bivariante (v = 2 + 2 - 2), ma dato che la p è definita, ad ogni composizione corrisponde una sola T; questo perché la fase solida è una sola (si tratta di una "soluzione" solida e non di una "miscela" dei due solidi). Si formano dei cristalli misti. Il liquido di composizione C1 inizia a separare cristalli di composizione C2; la T continua a scendere, con un continuo adeguamento della fase solida alla composizione che deve essere in equilibrio con il liquido corrispondente. Quando si giunge a T2 solidifica l'ultima frazione di liquido, di composizione C3; la fase solida ha ora la composizione C1. |
 |
La composizione dei cristalli misti varia continuamente e il sistema resta in equilibrio solo se il raffreddamento è lento.
Se non lo è sufficientemente, otterremo dei cristalli zonati.
| Fig.30.6
Sezioni di cristalli misti zonati. Ogni linea corrisponde alla formazione di cristalli in tempi successivi lungo la direzione della freccia. Poiché il raffreddamento è stato troppo veloce per permettere alla fase solida di mentenersi in condizioni di equilibrio, le zone interne sono più ricche nel componente B che cristallizza prima, le esterne in quello che cristallizza dopo, arrivando addirittura ad A quasi puro. Da notare che, in questo caso, il diagramma di stato non viene seguito, poiché esso presuppone sempre condizioni di equilibrio. |
 |
Perché due metalli possano dare cristalli misti, occorre che i loro atomi abbiano circa le stesse dimensioni; in tal caso si parla di soluzioni solide di sostituzione (per esempio le leghe Ni/Cu, Au/Pt, Au/Ag, Co/Ni), oppure che uno dei due abbia atomi molto più piccoli dell'altro, e allora si tratta di soluzioni solide interstiziali.
Sistemi invece come Zn/Cd, Bi/Pb, Sn/Cd, Cr/Fe, Au/Ni, presentano una solubilità parziale allo stato solido.
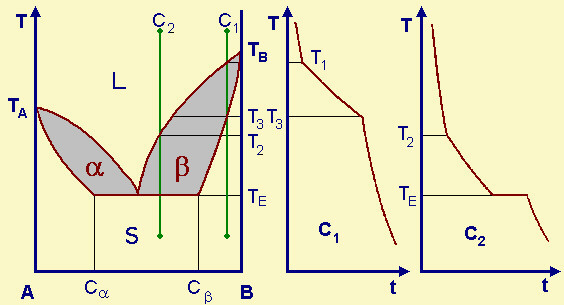
| Fig.30.7
Diagramma di stato con solubilità parziale allo stato solido. Alla fine si hanno soluzioni solide coniugate, quella di B in A, a, quella di A in B, b. Le forme a e b cristallizzano insieme a T=TE, come se si trattasse di un eutettico. Per C1 il comportamento è identico a quello della miscibilità completa. Per C2, la cristallizzazione inizia a T2, ma a T=TE c'è ancora liquido che cristallizza con formazione sia di a che di b, di composizioni Ca e Cb. E' ovvio che, se partiamo da una miscela di composizione eutettica, la solidificazione inizia e termina a T=TE, con separazione delle due fasi solide a e b, con rispettive composizioni Ca e Cb. |
 |