Corso di chimica generale ed inorganica
Vai all'INDICE GENERALE
19 - liquidi e solidi
Nella esperienza di Andrews abbiamo visto che i gas
possono passare (in certe condizioni) allo stato liquido, caratterizzato
da bassa comprimibilità (tratto finale del diagramma), cioè da spazi intermolecolari
molto ridotti.
Questo avviene quando le forze di
attrazione intermolecolari diventano predominanti su quelle dovute all'energia
cinetica.
Viene tuttavia conservata una certa
mobilità: il liquido infatti si adatta alla forma del recipiente.
Una conseguenza macroscopica della forza
di coesione in un liquido, cioè di queste forze di attrazione intermolecolari,
è la tendenza che esso ha ad assumere una forma sferica:
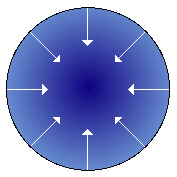
| Fig.19.1
Schema che rappresenta la forza di coesione di una porzione di sostanza liquida, per cui
essa tende, in assenza di altre forze, ad assumere forma sferica. Infatti le molecole interne risentono delle forze
in tutte le direzioni; quelle superficiali invece soltanto verso l'interno.
La superficie del liquido tenderà
perciò a contrarsi in modo da essere minima, a parità di volume (la situazione ideale è
perciò la sfera). |
 |
Questa caratteristica è molto
importante, per esempio, nel caso dei fenomeni legati alla capillarità,
coinvolti in problemi di risalita di acqua nelle murature (con trasporto anche di sali che
provocano, per cristallizzazione, degrado dei materiali), di idrorepellenza dei materiali
etc. La capillarità è un fenomeno dovuto all'interazione, generalmente a causa della
formazione di legami transitori a idrogeno, tra una soluzione e le pareti del contenitore:
quando predominano le forze di adesione del liquido rispetto alla parete, sulle forze di
coesione del liquido, il liquido stesso tende a risalire lungo la parete.
Un'altra caratteristica dei liquidi è la
viscosità, cioè la resistenza allo scorrimento; è presente anche nei
gas, ma è, in quasto caso, molto bassa (nei gas aumenta con la T, poiché aumentano gli
urti intermolecolari, mentre nei liquidi diminuisce all'aumentare di T).
E' importante evitare di confondere la
viscosità con la densità di un liquido, espressa generalmente in (g cm-3);
nel linguaggio comune, per esempio, si dice che l'olio è un liquido denso: è invece un
liquido "viscoso", non "denso", dato che, rispetto alla densità
dell'acqua, la densità di un olio è inferiore.
Un liquido estremamente viscoso può
essere considerato il vetro, che in effetti è un solido amorfo: non avendo una struttura
cristallina rigida, tende a deformarsi sotto l'azione di forze esterne: per esempio la
forza di gravità, in tempi lunghi, tende a far aumentare lo spessore di una lastra di
vetro nella sua parte inferiore.
Quando un liquido è in un recipiente
chiuso, le molecole che hanno energia cinetica sufficiente
(statisticamente ce ne sono sempre) passano allo stato di vapore,
occupando tutto lo spazio disponibile.
La pressione esercitata dal vapore in
equilibrio col liquido, a quella temperatura, si chiama tensione di vapore.
L'evaporazione di un liquido è
rallentata, in presenza di altri gas, dalla collisione delle molecole che tendono a
passare allo stato di vapore con molecole degli altri gas (N2, O2,
etc., se si tratta di aria). Se invece, mediante una pompa, si fa il vuoto, l'evaporazione
è veloce; ma, all'equilibrio, il numero di molecole di vapore, e perciò la sua pressione
parziale (ricordare la legge di Dalton per
miscele gassose), sono eguali.
Quando le forze di attrazione
diventano ancora più forti, possiamo avere lo stato solido,
caratterizzato da rigidità, incompressibilità, forma geometrica definita: ciò comporta
una disposizione regolare e stabile degli atomi (salvo che nel caso di sistemi vetrosi,
amorfi, assimilabili ad uno stato liquido estremamente viscoso).
Potremo avere perciò dei cristalli,
solidi omogenei e anisotropi (il comportamento fisico
può essere diverso a seconda della direzione considerata), delimitati da facce piane.
Potremo avere anche dei solidi
amorfi, con disposizione disordinata degli atomi (come nei liquidi) ma con forma
e volume propri; questi sono isotropi (le proprietà fisiche sono
costanti in tutte le direzioni).
Lo stato amorfo è generalmente
instabile: è detto metastabile, poiché si può avere un riarrangiamento
della struttura verso forme cristalline (che sono energeticamente favorite); il processo
è lentissimo data la altissima viscosità del sistema.
Nei cristalli possiamo
definire delle direzioni principali secondo cui si ha una ripetizione regolare delle
unità strutturali. Vediamo un esempio bidimensionale per semplicità.
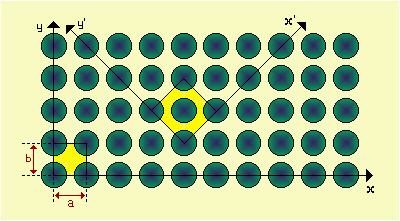
| Fig.19.2
Schema bidimensionale di una struttura cristallina. Ogni cerchio rappresenta una unità strutturale che si ripete
periodicamente e regolarmente lungo le varie direzioni.
Se prendiamo gli assi x
e y, l'unità ripetitiva avrà dimensioni a (lungo x) e b (lungo
y), con un angolo di 90° fra i due assi. Possiamo così definire una cella
elementare, di dimensioni a x b; è il minimo elemento di cristallo
che contiene in sé tutti i caratteri (di simmetria) del cristallo stesso, e da cui, per
ripetizione lungo gli assi, si può ricostruire il cristallo.
Se si fossero scelti, per esempio, gli
assi x' e y', si sarebbe individuata una diversa cella
elementare; ma si cerca sempre la più piccola e più simmetrica: infatti la prima ha una
sola unità entro la cella (1/4 di ogni cerchio), la seconda 2. |
 |
A seconda delle caratteristiche di simmetria
della cella elementare, si possono individuare dei gruppi di simmetria
e dei sistemi cristallografici.
In realtà questa schematizzazione si
riferisce particolarmente al cosiddetto "abito cristallino" dei
solidi, cioè alla forma macroscopica con cui essi si presentano (ma che è tuttavia in
relazione con la simmetria microscopica del sistema cristallino).
gruppi |
assi |
sistemi |
angoli |
|
|
|
|
MONOMETRICO |
a = b = c |
monometrico |
a = b = g = 90° |
|
|
|
|
DIMETRICO |
a = b ¹ c |
esagonale o trigonale |
a = b = 90° g = 120° |
|
|
tetragonale |
a = b = g = 90° |
|
|
|
|
TRIMETRICO |
a ¹ b ¹
c |
rombico |
a = b = g = 90° |
|
|
monoclino |
a = g = 90° b ¹ 90° |
|
|
triclino |
a ¹ b ¹ g ¹ 90° |
Fig.19.3 Gruppi e sistemi cristallini
e caratteristiche di simmetria degli assi cristallografici e degli angoli.
Nella figura successiva vengono
schematizzati, come esempio, i possibili tipi di celle elementari del sistema e gruppo
monometrico, cioè quello a massima simmetria.
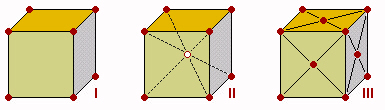
| Fig.19.4
Esempi di celle elementari appartenenti al gruppo monometrico. Queste corrispondono solo a 3 dei 14
reticoli di Bravais che descrivono tutti i possibili reticoli dei gruppi e dei
sistemi cristallografici.
Tutte e tre queste celle hanno la forma
di un cubo.
Cella I, Cubica P (Primitiva): 1 sola
unità in cella: 1/8 di ognuna delle 8 unità indicate in rosso appartiene alla cella.
Cella II, Cubica I (Corpo-centrata): 2
unità in cella: 1/8 di ognuna delle 8 unità indicate in rosso + quella al centro,
appartengono alla cella.
Cella III, Cubica F (Facce-centrata): 4
unità in cella: 1/8 di ognuna delle 8 unità indicate in rosso + 1/2 di ognuna delle 6 al
centro delle singole facce appartengono alla cella. |
 |
I 3 gruppi e i corrispondenti 6 sistemi,
le cui caratteristiche sono indicate in figura 19.3, possono venire descritti con soli 14
tipi di celle, detti reticoli di Bravais.
| gruppo
|
cella |
unità
in cella |
| monometrico |
Cubica P
(Primitiva) |
1 |
| monometrico |
Cubica I (Corpo-centrata) |
2 |
| monometrico |
Cubica F
(Facce-centrata) |
4 |
| dimetrico |
Tetragonale P
(Primitiva) |
1 |
| dimetrico |
Tetragonale I
(Corpo-centrata) |
2 |
| dimetrico |
Esagonale |
1 |
| dimetrico |
Romboedrica |
3 |
| trimetrico |
Ortorombica P
(Primitiva) |
1 |
| trimetrico |
Ortorombica C
(Faccia-centrata) |
2 |
| trimetrico |
Ortorombica I
(Corpo-centrata) |
2 |
| trimetrico |
Ortorombica F
(Facce-centrata) |
4 |
| trimetrico |
Monoclina P
(Primitiva) |
1 |
| trimetrico |
Monoclina C
(Faccia-centrata) |
2 |
| trimetrico |
Triclina |
1 |
Fig.19.5 I 14 reticoli di Bravais,
con i relativi numeri di unità in cella, rispetto ai gruppi cristallografici.
La struttura cristallina è
caratteristica di quasi tutti i composti e gli elementi a livello macroscopico.
Le forze che tengono uniti elementi e
composti sono quelle di cui abbiamo parlato nel caso dei legami: cioè covalente,
ionico, di
idrogeno, metallico, di Van
der Waals.
Se un composto può presentarsi in forme
cristalline diverse, si dice che dà luogo a polimorfismo; se invece due
composti diversi si presentano con la stessa forma cristallina, si dice che possono dare cristalli misti; succede, per esempio, negli
spinelli, di formula generale: A2BO4, in cui
A può essere Al3+, Cr3+,
Fe3
B può essere Mg2+, Zn2+,
Mn2+


